ИСКУССТВЕННАЯ ПОЧКА
— аппарат для выведения из организма токсических продуктов обмена и экзогенных ядов, а также для регуляции электролитно-водного баланса и кислотно-щелочного равновесия посредством диализа и ультрафильтрации крови.
Искусственная почка временно замещает функции почек по поддержанию гомеостаза (см.), но не моделирует почечные процессы (клубочковую фильтрацию, канальцевую реабсорбцию и секрецию и др.) и инкреторную функцию.
Гемодиализ (см.) — освобождение крови от кристаллоидов благодаря избирательной диффузии веществ через полупроницаемую мембрану. В Искусственной почке эта мембрана отделяет стерильную кровепроводящую систему от нестерильной системы, проводящей диализирующий р-р. В зависимости от проницаемости мембраны, ее площади, конструкции аппарата, температуры р-ра, разности концентраций веществ по обе стороны мембраны, размера и формы их молекул и др. диализ разных веществ в различных типах И. п. происходит неодинаково быстро.
Ультрафильтрация (см.) — удаление из организма воды вследствие разницы гидростатического и осмотического давления по обе стороны полупроницаемой мембраны. Необходимый для ультрафильтрации градиент давления достигается в И. п. гл. обр. за счет положительного давления в кровепроводящей системе и отрицательного давления в системе диализирующего р-ра. Процесс удаления воды можно усилить, увеличив осмотическое давление диализирующего р-ра за счет добавления осмотически активных веществ (глюкоза, маннитол).
История
Работы по созданию И. п. начались с исследования Абеля (J. J. Abel) и сотр. (1913), которые разработали первый прототип аппаратуры для гемодиализа, названный «искусственная почка». Аппарат представлял собой ряд трубок, сделанных из полупроницаемой мембраны (коллодий), размещенных в стеклянном цилиндре и объединенных в общий коллектор у начала и конца цилиндра. Цилиндр заполняли физиол. р-ром поваренной соли (диализирующий р-р). Аппарат присоединяли к кровеносным сосудам животного, обеспечивая циркуляцию крови через него за счет АД. Для предотвращения свертывания крови вводили антикоагулянт гирудин. Проведенные исследования показали, что из крови можно удалять продукты метаболизма и токсические вещества экзогенного происхождения. Эти исследования имели большое научное значение, однако аппаратура и методика ее применения были весьма несовершенны.
Нехелес (H. Necheles, 1923) впервые применил созданное им устройство, в к-ром для удаления продуктов белкового метаболизма у собак с экспериментальной уремией в качестве полупроницаемой мембраны использовалась брюшина. Первое применение И. п. у человека было осуществлено Хаасом (G. Haas, 1925— 1927). Созданный им аппарат был использован для лечения уремической интоксикации. Несмотря на отсутствие явного клин, эффекта, удалось отметить удаление с р-ром нек-рого количества метаболитов азотистого обмена. В работах Хааса впервые для продвижения крови через аппарат был использован специальный насос. Для создания искусственной гемофилии во время гемодиализа Лим (Р. К. S. Lim) и Нехелес (1926) впервые применили гепарин (см.) вместо использовавшегося ранее токсичного и трудностандартизируемого гирудина.
Серьезной трудностью в создании И. п. долгое время оставалось отсутствие полупроницаемой мембраны, отвечающей требованиям гемодиализа. Многочисленные варианты таких мембран (коллодий, плавательный пузырь рыб, брюшина теленка и др.) в силу нестандартности и низкой механической прочности оказались неприемлемыми для широкого использования. Эта задача была решена Талхаймером (W. Thalhimer, 1938), впервые предложившим и испытавшим для этой цели целлофан.
Накопленный опыт, особенно применение гепарина и целлофана, создали необходимые предпосылки для разработки первого пригодного для широкого клин, применения варианта аппарата И. п., созданного в 1943 г. врачом У. Колффом в содружестве с инженером Берком (Н. Berk). Вскоре Н. Альваллем (1946) была создана И. п., к-рая наряду с диализом могла обеспечивать и ультрафильтрацию. В последующие годы лечение с помощью И. п. начало применяться во все более широких масштабах. Было создано большое число моделей, отличающихся по конструкции ряда основных узлов.
В нашей стране создание аппарата И. п. было начато в 1955 г. по инициативе акад. В. В. Ларина. Впервые аппарат И. п. для лечения больных почечной недостаточностью был применен в начале 1958 г. А. Я. Пытелем, Н. А. Лопаткиным, а первый советский аппарат, созданный группой врачей и инженеров (М. Г. Ананьев, Ю. Г. Козлов, Е. Б. Горбовицкий и др.),— в 1960 г.
Аппараты для гемодиализа
При нарушениях функции работы почек сегодня применяют диализ, когда используется специальный аппарат, очищающий кровь от отходов, солей и избытка жидкости. Но эта процедура, выполняемая обычно в больнице, как правило трижды в неделю, очень утомительна для пациентов и работает только тогда, когда человек подключен к этому аппарату в клинике или диализном центре. Сегодня сразу несколько коллективов ученых работают над этой проблемой, чтобы облегчить жизнь таким пациентам.
System One
NxStage Medical создала диализную систему System One, которая может использоваться непосредственно на дому у пациентов без привлечения для этого медицинских специалистов. Это единственное в мире устройство, которое имеет официальное разрешение от FDA на проведение ночного гемодиализа, что позволяет проходить лечение как обычно днем или ночью во время сна. При этом в устройстве может использоваться как диализат в стандартных емкостях, так и система PureFlow SL, которая приготовляет диализат из водопроводной воды. System One — устройство легкое, что позволяет переносить ее в любое удобное пользователю место или даже брать с собой при путешествиях.
AWAK PD
Компания AWAK Technologies разработала носимую систему перитонеального диализа AWAK Peritoneal Dialysis (AWAK PD). При перитонеальном диализе проводится очистка крови, причем в качестве мембранного фильтра используется брюшина самого пациента. Система AWAK позволяет проводить диализ «на ходу», преодолевая проблему долгих часов терапевтической процедуры и необходимости подключения к аппарату диализа.
При таком диализе раствор для перитонеального диализа вводят через постоянную трубку в брюшную полость, и там же происходит процесс очистки. Жидкость остается в брюшной полости в течение определенного периода времени, прежде чем она будет слита и утилизирована. Если этот метод сравнивать с гемодиализом, то его преимуществом является возможность использования маленькими детьми.
Это первое в мире подобное устройство в значительной мере изменило режим проведения перитонеального диализа.
Основные элементы
Все аппараты И. п., несмотря на разнообразие конструктивных решений, имеют одинаковую принципиальную схему и состоят из следующих основных элементов: 1) диализатор; 2) перфузионное устройство для продвижения крови через аппарат; 3) устройство для приготовления и подачи в диализатор диализирующего р-ра; 4) устройства, контролирующие и регулирующие основные технико-медицинские параметры гемодиализа (монитор).
Рис. 1—4. Схематические изображения различных диализаторов. Рис. 1. Катушечный диализатор: 1 — ввод для крови; 2 — корпус диализатора; 3 —вывод для диализирующего раствора; 4 — дренирующая арматура; 5 — спирально свернутая трубчатая мембрана; 6 — ввод для диализирующего раствора; 7 — вывод для крови. Рис. 2. Капиллярный диализатор: 1 — ввод для крови; 2 — распределительная камера; 3 — корпус диализатора; 4 — ввод для диализирующего раствора; 5 —вывод для крови; 6— капилляры; 7 — вывод для диализирующего раствора; 8 — герметизирующий слой. Рис. 3. Одноразовый пластинчатый диализатор: 1 — наружные прижимные пластины корпуса; 2—пластина диализатора; 3 — мембраны; 4 — распределительная плата; 5—стяжные скобы корпуса; 6 — ввод для диализирующего раствора; 7 —вывод для крови; 8 — вывод для диализирующего раствора; 9 — ввод для крови. Рис. 4. Пластинчатый диализатор СГД-6: 1 — верхняя прижимная рама; 2— пластина диализатора; 3— мембрана; 4 — ввод для диализирующего раствора; 5 — вывод для крови; 6 — распределитель для крови; 7 —резиновый уплотнитель пластины; 8 — стяжные болты; 9 —распределитель для диализирующего раствора; 10 — нижняя прижимная рама; 11 — ввод для крови; 12 — вывод для диализирующего раствора; слева внизу —общий вид диализатора.
Диализатор (гемодиализатор)
. Разработано и используется значительное число различных вариантов диализаторов, отличающихся по конструкции, используемым материалам и мембранам (цветн. рис. 1—4). Все они могут быть разделены на основные группы: диализаторы в форме барабанов (подвижных и неподвижных); в форме катушек; диализаторы пластинчатого типа; капиллярные.
Первая И. п., разработанная У. Колффом, имела диализатор в форме вращающегося барабана, на который спирально в один слой была намотана целлофановая трубка. Кровь в трубке перемещалась по принципу винта Архимеда. Хотя диализатор Колффа и диализаторы с неподвижным барабаном (Альвалля, Баттезатти, Меллера) из-за их громоздкости, сложности сборки, большого объема первичного заполнения и других недостатков практически не используются, они были основой для последующих разработок.
Диализаторы катушечного типа, разработанные У. Колффом и Уочингером (В. Watchinger) в 1956 г., представляют собой трубку из полупроницаемой мембраны, намотанную в несколько слоев на твердую основу цилиндрической формы. Для предотвращения увеличения объема трубки при циркуляции через нее крови она с двух сторон ограничена пластиковыми сетками, не затрудняющими в то же время контакт между мембраной и диализирующим р-ром.
Диализаторы пластинчатого типа впервые разработаны Скеггсом и Леонардсом (L. Т. Skeggs, J. R. Leonards, 1948). В этих диализаторах основными элементами конструкции служат листы полупроницаемой мембраны, которые закрепляются между пластинами из полимера, снабженными продольными канавками, с помощью которых при заполнении диализатора кровью формируется ее направленный поток. Снаружи полупроницаемая мембрана омывается диализирующим р-ром. Объединяя необходимое число упомянутых выше конструктивных элементов, можно получить диализаторы с заданной рабочей площадью. К числу пластинчатых диализаторов относятся модели Kiil, Gambro, Rhone — Poulenc, a также диализаторы, использующиеся в отечественных аппаратах И. п. (АИП-140, Диахрон-80, СГД-6, Диацентр-1 и др.).
Широкое применение находят так наз. капиллярные диализаторы. Их основой являются тонкостенные (11—30 мкм) капилляры из полупроницаемой мембраны с внутренним диаметром порядка 200—260 мкм. Объединенные в пучки, содержащие тысячи таких трубок, они помещаются в цилиндрические футляры из прозрачного пластика. В начале и конце такого цилиндра все промежутки между капиллярами герметизируются специальным составом, отделяя т. о. кровепроводящую систему от системы циркуляции диализирующего р-ра, поступающего через боковые штуцеры цилиндра.
Полупроницаемые мембраны, используемые в И. п., являются важнейшим функциональным элементом аппарата. От их особенностей в основном зависят эффективность И. п. и ее безопасность для больного. Существуют следующие основные требования к мембране, она должна:
1) не оказывать неблагоприятного действия на кровь и не выделять при контакте с нею токсических продуктов (на полупроницаемую мембрану приходится не менее 95% всей инородной поверхности, с к-рой соприкасается кровь при прохождении через И. п.); 2) обеспечивать эффективное удаление метаболитов и токсических продуктов экзогенного происхождения; 3) обеспечивать нужную скорость ультрафильтрации; 4) не пропускать белок; 5) обладать высокой прочностью, предотвращающей разрыв мембраны при механических нагрузках и температурном режиме.
Большинство применяемых мембран изготавливают из производных целлюлозы (целлофан, купрофан, нефрофан и др.). Размеры пор в этих мембранах составляют 1,5—2,5 нм, толщина мембран колеблется от 10 до 20 мкм. Мембраны существенно отличаются по диализирующей активности и способности к ультрафильтрации, что позволяет осуществлять их рациональный подбор при проведении гемодиализа.
Определенное место в развитии уремического синдрома отводится так наз. среднемолекулярным метаболитам, хим. природа которых не расшифрована. В связи с этим были разработаны (на основе полиакрил-нитрила и некоторых других полимеров) мембраны, характеризующиеся значительно более высокими показателями очищения среднемолекулярных веществ по сравнению с обычными мембранами для гемодиализа. Эти мембраны обладают в несколько раз большей ультрафильтрационной активностью, что позволяет удалить при гемодиализе большее количество жидкости (до нескольких литров в час), а также использовать их в специальных ультрафильтраторах (например, для резкого уменьшения объема асцитической жидкости перед ее реинфузией). Однако в большинстве случаев чрезмерно высокая ультрафильтрационная активность этих мембран создает трудности, связанные с необходимостью тщательно контролировать потери жидкости при гемодиализе и своевременно компенсировать избыточные ее потери. Проводятся исследования, направленные на создание мембран, которые обладали бы высокой очищающей способностью по отношению к среднемолекулярным метаболитам и при этом сохраняли бы ультрафильтрационную активность, близкую к активности мембран из купрофана и др. Вместе с тем мембраны с высокими показателями ультрафильтрации могут оказаться незаменимыми для разрабатываемого нового типа аппарата И. п., действие к-рого основано на принципе диафильтрации.
Диализаторы выпускаются с различной площадью диализной поверхности (от 0,24 до 2,5 м2) в соответствии с особенностями их применения (напр., с небольшой площадью для педиатрической практики и т. д.). В зависимости от этого меняются очищающая и ультрафильтрационная мощность, а также другие параметры (напр., объем первичного заполнения). Наиболее важные параметры, характеризующие различные диализаторы,— размеры, метод стерилизации, время подготовки к работе, объем первичного заполнения, остаточный объем, клиренс по низко-молекулярным веществам, клиренс по среднемолекулярным веществам, ультрафильтрация, внутреннее сопротивление, частота прорывов мембраны, возможность повторного использования.
Выпускаются диализаторы как для однократного, так и многократного использования. Все диализаторы капиллярного и катушечного типов и ряд моделей пластинчатых диализаторов — однократного использования. Эти диализаторы выпускаются полностью собранными, простерилизованными и готовыми к немедленному использованию. При соблюдении определенных предосторожностей некоторые из них могут использоваться повторно. По данным Европейской ассоциации диализа и трансплантации (1975), при проведении гемодиализа в стационаре чаще применяют диализаторы однократного использования, при лечении в домашних условиях и тот и другой тип — примерно с равной частотой.
Основными показателями эффективности И. п. являются клиренс и диализанс, которые показывают, какой объем диализируемой жидкости полностью очищается от данного вещества за единицу времени (мин.) при избранной скорости перфузии. Клиренс и диализанс рассчитываются по формуле Вольфа (A. Wolf, 1952):
C = (A — R)*a/A; D = (A — R)*a/(A — U),
где С — клиренс (мл/мин); D — диализанс (мл/мин); А — концентрация вещества на входе в диализатор; R — концентрация вещества на выходе из диализатора; U — концентрация вещества в диализирующем р-ре; а — скорость диализируемой жидкости (мл/мин).
Клиренс характеризует аппарат при постоянном обновлении р-ра, в к-ром на входе в диализатор отсутствует исследуемое вещество. Диализанс характеризует аппарат также и при рециркуляции диализирующего р-ра, когда в процессе диализа в нем нарастает концентрация исследуемого вещества и клиренс соответственно падает.
Для определения эффективности И. п. обычно исследуют клиренс мочевины и креатинина. Для этой цели применяются р-ры мочевины (3 г/л) и р-р креатинина (0,2 г/л). На одно исследование необходимо ок. 20 л р-ра. В качестве диализирующего р-ра используется дист. вода. Температура обоих р-ров — 37°. Исследование проводят при прохождении диализируемого р-ра через диализатор со скоростью от 50 до 250 мл/мин. Пробы берут после того, как диализатор работал в стабильных условиях ок. 15 мин.
Перфузионное устройство.
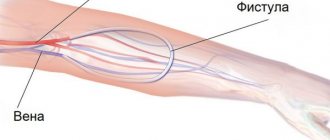
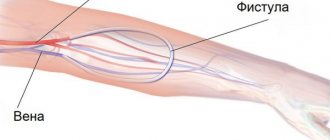
Соединение больного с аппаратом можно осуществлять различными способами. В острых случаях, когда имеется надежда на быстрое восстановление функции почек, нередко используют специальные катетеры, введенные в крупные вены. При хрон, почечной недостаточности или при затяжном течении острой почечной недостаточности наиболее часто используют артериовенозные шунты или артериовенозную фистулу (см. Гемодиализ). При использовании метода катетеризации и при работе с помощью артериовенозной фистулы необходимо применять специальные перфузионные насосы, тогда как артериовенозный шунт часто обеспечивает кровоток в аппарате без насоса. Существуют различные типы насосов: мембранные, роликовые, сигма-насосы. Чаще находят применение роликовые насосы. Иногда для оценки интенсивности перфузии используют и расходомеры по крови (допплеровские, электромагнитные, шариковые и др.). Для введения в кровь различных лекарственных веществ, в частности гепарина и протаминсульфата, обычно используют два типа насосов: шприц-насосы и реже роликовые.
Устройство для приготовления и подачи диализирующего раствора.
Опыт применения И. п. показал, что диализирующий р-р должен содержать катионы натрия, калия, кальция, магния и анионы ацетата (или бикарбоната, лактата) и хлора. При выраженной внесосудистой гипергидратации в р-р иногда добавляют то или иное количество глюкозы, но не больше 3000 мг%, поскольку более высокие концентрации могут приводить к осложнениям (гипергликемия, судороги и др.).
Диализирующий р-р может меняться в известных пределах, напр, в зависимости от клин, требований, а также от состава воды, используемой для приготовления р-ра. Наибольшим вариациям подвергается содержание калия. Количество вводимых в р-р кальция и магния может зависеть от их содержания в воде. В ряде мест водопроводная вода содержит избыток солей кальция, магния и других солей, и тогда требуется предварительная подготовка воды, для чего используют несколько методов. Дистилляция позволяет получить хорошо очищенную воду, но способ этот дорог, поэтому чаще используют деминерализацию воды с помощью ионообменных смол.
В более простом варианте, когда требуется удалить только кальций и магний, применяют смягчение воды, что достигается с помощью только катионитов. Все шире в практику гемодиализа стал входить метод подготовки воды с помощью обратного осмоса. Для механической очистки воды от ржавчины, органических взвесей и других загрязнений используют различные системы фильтрования.
Готовят диализирующий р-р двумя способами. В ряде аппаратов И. п. в определенный объем воды добавляют сухие соли или их концентрированные р-ры, чтобы получить нужную концентрацию после их растворения. Кроме того, применяют автоматический способ непрерывного приготовления диализирующего р-ра из так наз. концентрата и воды. В концентрате содержание всех составляющих его солей в 30—35 раз выше, чем в диализирующем р-ре. Поэтому одну часть концентрата разводят 34 частями воды, что осуществляется с помощью специальных устройств — дозаторов.
Диализирующий р-р в И. п. используют тремя способами. 1. Рециркуляция. Готовый диализирующий р-р находится в одной емкости и, пройдя диализатор, снова возвращается в ту же емкость. Поскольку концентрация вымываемых из организма продуктов обмена в р-ре постоянно повышается, требуется периодическая замена его свежим р-ром. Периодичность смены определяется емкостью бака и быстротой накопления в р-ре шлаков. 2. Система «на слив». Диализирующий р-р однократно проходит через диализатор и сливается в канализацию.
Имеются системы, в которых отработанный р-р подвергают регенерации, после чего он снова поступает в циркуляцию. Фактически здесь используется принцип рециркуляции, но характер диализа приближается к системе «на слив». 3. Сочетание рециркуляции и системы «на слив». Через диализатор с большой скоростью протекает нек-рое количество диализирующего р-ра, но постоянно определенное количество отработанного р-ра сливается в канализацию и одновременно такое же количество свежего добавляется в бак.
Контроль за работой искусственной почки. Хим. контроль за составом диализирующего р-ра выполняется методом пламенной фотометрии (определение концентрации ионов натрия, калия и др.)- Если речь идет о системе рециркуляции, то достаточно одного определения в начале диализа.
В системах, работающих «на слив», состав диализирующего р-ра постоянно контролируется с помощью солемеров. Обычно используется два прибора, чтобы повысить надежность наблюдения. Работа солемеров в свою очередь также периодически подвергается проверке с помощью пламенной фотометрии (см.) или осмометрии (см. Осмотическое давление).
Помимо хим. контроля, в ходе гемодиализа требуется постоянный контроль за температурой диализирующего р-ра. Все системы гемодиализа снабжены нагревателями и терморегуляторами, которые автоматически поддерживают заданную температуру р-ра.
При работе с бикарбонатным буфером для стабилизации pH диализирующего р-ра применяют продувание его смесью кислорода и углекислого газа, и поэтому требуется частый контроль pH раствора.
Современные аппараты И. п. включают в себя мониторы, обеспечивающие контроль давления крови в аппарате, попадания воздуха в кровоток больного, утечки крови в диализирующий р-р, а также скорости прохождения через И. п. диализирующего р-ра и давления его в диализаторе. Измерение величины ультрафильтрации в течение гемодиализа осуществляется гл. обр. с помощью кровати-весов, не входящих в И. п. При нарушении целости мембраны и выходе крови в диализирующий р-р срабатывают автоматические системы прекращения гемодиализа. Применяют так наз. детекторы уровня, или воздушные детекторы, которые следят за уровнем крови в специальной камере (ловушка воздуха) венозной магистрали, что надежно предупреждает возможность воздушной эмболии. Датчики давления контролируют уровень положительного давления крови в диализаторе. Скорость движения р-ра также может широко варьировать, и поэтому почти все аппараты И. п. снабжены расходомерами (флоуметрами).
Безопасность больного основана на том, что в И. п. имеются приборы, которые в случае повышения или занижения заданных условий подают световые и звуковые сигналы тревоги. В некоторых случаях, как, напр., при превышении установленного давления крови, при попадании воздуха в кровепроводящую систему, крови в диализирующий р-р, при увеличении температуры диализирующего р-ра выше установленных границ, поток крови и диализ автоматически прерываются. Прерывание потока крови осуществляется посредством электромагнитных зажимов.
Kidney Project (Калифорнийский университет в Сан Франциско)
Самая известная разработка в этой сфере ведется в рамках Kidney Project, в котором работают специалисты Калифорнийского университета из Сан-Франциско и университета Вандербильта (США). Они разработали имплантат размером с кофейную чашку, который способен выполнять функции почки и стать великолепным решением для пациентов с хроническим заболеванием почек. Это не очень большое хирургически имплантированное устройство состоит из высокопроницаемого фильтрационного блока и клеток почек человека.
Фильтрующий компонент имеет микропоры, которые могут иметь индивидуальную форму для того, чтобы выполнять определенные задачи. Эти фильтры могут располагаться один за другим, каждый из которых будет выполнять разную функцию фильтрации. Всего устройство содержит в себе пятнадцать таких фильтров, помещенных один поверх другого. Между такими фильтрами и вокруг них находятся живые клетки почки, которые выполняют функции, которые искусственные компоненты выполняют недостаточно хорошо, включая реабсорбцию питательных веществ и избавление от накопленных отходов. Поскольку такое гибридное биологическое устройство будет размещаться вне досягаемости иммунной реакции организма, оно будет таким образом защищено от отторжения человеческим телом.
Т.е. устройство содержит живые клетки, оно теоретически может не только фильтровать кровь, но и выполнять другие важные функции настоящей почки, такие как выделение гормонов для контроля кровяного давления.
Кроме фильтров, которые разделяют различные субстанции в крови, в состав имплантата входит «биореактор», который обрабатывает ультрафильтрат, выделяет из него сахар и соли, которые возвращает в кровь. В этом процессе вода реабсорбируется также обратно в тело, а ультрафильтрат превращается в «мочу», которая направляется в мочевой пузырь для удаления из организма. Эти устройства помещены в прочный корпус, покрытый пленкой из материала, который безопасен для использования внутри нашего тела. Имплантат соединен трубками с расположенными рядом венами и мочевым пузырем.
Питание устройство получает за счет давления крови пациента и этот прибор не требует использования внешних трубок или кабелей, которые сегодня ассоциируются с носимой искусственной почкой.
Очищенная кровь возвращается в систему кровообращения через вены, подключенные к имплантату, а отходы перемещаются в мочевой пузырь через соответствующую трубочку. Все элементы, через которые проходит кровь, имеют покрытие, которое должно препятствовать образованию тромбов. Кроме того, образованию тромбов препятствует специальном образом разработанная схема кровотока внутри системы.
По словам разработчиков, устройство не будет выполнять все функции человеческой почки. «Но цель заключается в том, чтобы оно выполняло критически важные функции и было системой, которая после имплантации позволяла пациенту свободно есть и пить, иметь мобильность, лучшее состояние здоровья в целом, и, в отличие от трансплантата, не требовать применения иммунодепрессантов», — заявляют университетские ученые.
Отметим, что при этом пациенты все равно должны принимать гормональные добавки, которые они используют при прохождении процедур диализа.
Тестирование рабочего прототипа предполагается провести в 2020 году.
Стерилизация
Стерильность и апирогенность диализаторов и кровепроводящей системы более надежны в одноразовых устройствах. Все элементы, которые в ходе диализа имеют контакт с кровью больного, собирают в заводских условиях, упаковывают и стерилизуют с помощью окиси этилена, гамма-облучением или формалином. Существенный недостаток систем однократного использования— их дороговизна. Поэтому еще широко используются диализаторы повторного применения. В этих случаях подготовка аппарата к работе осуществляется непосредственно в леч. учреждении. Перед употреблением диализатор и магистрали крови заполняют 2% р-ром формалина, что дает наиболее полный стерилизационный эффект. Непосредственно перед операцией систему отмывают стерильным физиол, р-ром с гепарином (требуется 2 л физиол, р-ра). Подготовка аппарата к работе занимает всего 30—40 мин. Систему диализирующего р-ра периодически подвергают стерилизации формалином. Это особенно важно для аппаратов с рециркуляцией, т. к. в этом случае бактериальное загрязнение системы диализа происходит очень быстро, что может повести к возникновению пирогенных реакций за счет проникновения бактериальных токсинов через мембрану.
Рекомендации
- «Анатомия почек: Обзор, Макро-анатомия, Микроскопическая анатомия». 2017-08-29. Цитировать журнал требует | журнал = (помощь)
- «Почки и как они работают». www.niddk.nih.gov
. Получено 2015-11-30. - «Обзор почек». WebMD
. Получено 2015-12-02. - «Ключевые моменты: о диализе при почечной недостаточности». www.kidney.org
. Национальный фонд почек. 2021 г. - ^ абcdеж
Джонсон, Стивен (2014-10-11). «Спрос на диализ растет по мере роста заболеваний почек».
www.modernhealthcare.com
. Современное здравоохранение. - Bywaters EGL, Beall D (1941). «Размозки с нарушением функции почек». Британский медицинский журнал
.
1
(4185): 427–32. Дои:10.1136 / bmj.1.4185.427. ЧВК 2161734. PMID 20783577. - ^ абc
«Быстрые факты».
Национальный фонд почек
. Национальный фонд почек. 2014-08-12. Получено 2016-11-13 — через kidney.org. - Твардовский, Збылут Дж. (9 августа 1994 г.). «Искусственная почка для частого (ежедневного) гемодиализа». Патент США
. - Фиссел У.Х., Хьюмс HD, Флейшман А.Дж., Рой С. (2007). «Диализ и нанотехнологии: сейчас, 10 лет или никогда?». Очищение крови
.
25
(1): 12–17. Дои:10.1159/000096391. PMID 17170531. - Линдси RM, Le itch R, Heidenham AP, Kortas C (2003). «Лондонское исследование ежедневного / ночного гемодиализа: дизайн исследования, результаты заболеваемости и смертности». Am J Kidney Dis
. 42 Дополнение 1: S5 – S12. Дои:10.1016 / S0272-6386 (03) 00531-6. - Фиссел В., Мэнли С., Уэстовер А., Хьюмз HD, Флейшман А. Дж., Рой С. (2006). «Дифференцированный рост клеток почечных канальцев человека на тонкопленочных и наноструктурированных материалах». Журнал ASAIO
.
52
(3): 221–227. Дои:10.1097 / 01.mat.0000205228.30516.9c. PMID 16760708. - «Успешно продвигается проект по имплантации искусственной почки — Новости и проблемы нефрологии». Новости и проблемы нефрологии
. 2016-02-25. Получено 2016-12-07. - «Первая в мире имплантируемая искусственная почка может пройти испытания на людях к 2021 году». Медицинское устройство онлайн
. Получено 2016-12-07. - ^ абcdежграммчасяj
Ронко, Клаудио; Давенпорт, Эндрю; Гура, Виктор (01.07.2008). «К носимой искусственной почке».
Международный гемодиализ
.
12
: S40 – S47. Дои:10.1111 / j.1542-4758.2008.00295.x. ISSN 1542-4758. PMID 18638240. - ^ аб
Гура, Виктор; Ривара, Мэтью Б .; Бибер, Скотт; Мунши, Радж; Смит, Нэнси Колобонг; Линке, Лори; Кундзиньш, Джон; Бейзаи, Масуд; Эзон, Карлос (2016). «Носимая искусственная почка для пациентов с терминальной почечной недостаточностью».
JCI Insight
.
1
(8). Дои:10.1172 / jci.insight.86397. ISSN 2379-3708. ЧВК 4936831. PMID 27398407. - ^ аб
Гура, Виктор; Macy, Alexandra S .; Бейзаи, Масуд; Эзон, Карлос; Голпер, Томас А. (07.12.2016). «Технический прорыв в носимой искусственной почке (WAK)».
Клинический журнал Американского общества нефрологов
.
4
(9): 1441–1448. Дои:10.2215 / CJN.02790409. ISSN 1555-9041. ЧВК 2736696. PMID 19696219. - ^ аб
Маркович, М .; Рапин, М .; Корревон, М .; Перриар, Ю. (01.09.2013). «Дизайн и оптимизация перфузионного насоса для носимого устройства искусственной почки».
IEEE Transactions по отраслевым приложениям
.
49
(5): 2053–2060. Дои:10.1109 / TIA.2013.2260851. ISSN 0093-9994. - ^ аб
Ким, Чон Чоль; Гарзотто, Франческо; Налессо, Федерико; Круз, Динна; Ким, Джи Хён; Канг, Ынгтэк; Ким, Хи Чан; Ронко, Клаудио (2011). «Носимая искусственная почка: технические требования и возможные решения».
Экспертиза медицинских изделий
.
8
(5): 567–579. Дои:10.1586 / erd.11.33. PMID 22026622. - Сайто А., Аунг Т., Секигучи К., Сато И, Ву Д., Инагаки М., Канай Г., Танака Р., Сузуки Н., Какута Т. (2006). «Современное состояние и перспективы биоискусственных почек». J Artif Organs
.
9
(3): 130–5. Дои:10.1007 / s10047-006-0336-1. PMID 16998696. - Сайто А., Аунг Т., Сэкигучи К., Сато И (2006). «Современное состояние и перспективы развития биоискусственной почки для пациентов с хронической почечной недостаточностью». Ther Apher Dial
.
10
(4): 342–7. Дои:10.1111 / j.1744-9987.2006.00387.x. PMID 16911187. - Ван П., Такедзава Т. (2005). «Реконструкция почечной клубочковой ткани с использованием коллагенового витригеля». J Biosci Bioeng
.
99
(6): 529–40. Дои:10.1263 / jbb.99.529. PMID 16233828. - Фиссел В., Флейшман А. Дж., Рой С., Хьюмз HD (2007). «Развитие непрерывной имплантации почек: прошлое и будущее». Трансляционные исследования
.
150
(6): 327–336. Дои:10.1016 / j.trsl.2007.06.001. PMID 18022594. - «Главная | Проект почек | UCSF». Pharm.ucsf.edu
. Получено 2018-12-11. - «Искусственные почки исключают диализ». 2017-11-09.
Возможные осложнения и побочные эффекты
Процедура проведения очистки крови не такая уж и безопасная, как хотелось бы. Искусственная почка в некоторых случаях приводит к таким побочным эффектам, как:
- зуд кожи в месте введения катетера;
- снижение уровня эритроцитов;
- скачки давления;
- боли и мышечные спазмы;
- нарушения сна;
- уменьшение прочности костной ткани.
Также существует вероятность возникновения и более серьезных осложнений, в частности таких, как воспаление перикардита. Может происходить сбой работы аппаратуры, что приводит к смерти пациента.
Функция искусственной почки
Аппарат «искусственная почка» применяется в том случае, если собственный орган теряет свою функциональность на 85-90 %. Этот аппарат помогает:
- удалить из крови мочевину;
- улучшить обменные процессы;
- вывести переизбыток жидкости;
- контролировать кислотно-щелочной баланс;
- предотвратить образование тромбов.
Кроме того, он помогает насытить кровь воздухом, что позволяет улучшить самочувствие больного. Благодаря современной портативной технике можно проводить гемодиализ в любое удобное время, не выходя из дома.