Как проходит процедура взятия мазка?
Мазок у мужчин берут с помощью специального зонда или ватного тампона, который достаточно глубоко вводится в уретру. Пациент при этом часто испытывает довольно неприятные и даже болезненные ощущения. Жжение и боль в головке полового члена могут сохраняться в течение нескольких часов после процедуры. Полученный с помощью зонда материал наносится на предметное стекло для микроскопического исследования. Часть материала отправляется на ПЦР-диагностику, которая позволяет установить точный тип возбудителя, если у пациента имеется инфекционное заболевание.
Вторичный гипогонадизм у мужчин
28.12.2020
2627
0
В продолжение первого доклада о первичном гипогонадизме у мужчин андролог, уролог, заведующий отделением андрологии и урологии НМИЦ акушерства, гинекологи и перинатологии имени В.И. Кулакова профессор Сафар Исраидович Гамидов выступил с обширной лекцией об особенностях вторичного гипогонадизма у мужчин и доступных режимах терапии.
С.И. Гамидов
Д.м.н., профессор, ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» (г. Москва)
Как напомнил Сафар Исраилович, для специалиста-андролога обязательным является понимание физиологической роли гормонов, умение интерпретировать эндокринные показания с диагностической целью, а также назначать гормональные препараты с ожидаемым терапевтическим эффектом.
Существует ряд случаев, когда андрологу следует задуматься о назначении гормональной терапии:
- детская урология: крипторхизм, гипоспадия, микропенис;
- гипогонадизм, в том числе с ассоциированной эректильной дисфункцией;
- гиперпролактинемия;
- бесплодие (олигозооспермия, фрагментация ДНК сперматозоидов);
- необходимость в мужской контрацепции;
- приапизм;
- доброкачественная гиперплазия простаты;
- рак простаты с неблагоприятными прогностическими признаками.
Репродуктивная функция у мужчин работает благодаря гипоталамо-гипофизарно-гонадной системе. В гипоталамусе важно инфундибулярное ядро, содержащее KNDy-нейроны (субпопуляция нейронов аркуатного ядра) и ГнРГ-нейроны. В переднем гипофизе гонадотрофы вырабатывают лютеинизирующий (ЛГ) и фолликулостимулирующий (ФСГ) гормоны. В свою очередь, гонады продуцируют половые стероиды и гаметы под влиянием ЛГ и ФСГ.
В регуляции гипоталамо-гипофизарно-гонадной системы важную роль играют тестостерон, эстрадиол, ЛГ, ФСГ, пролактин, активины и ингибины, а также антимюллеров гормон.
В 1977 г. группы A. Schally и R. Guillemin были удостоены Нобелевской премии за открытие гонадолиберина (гонадотропин-релизинг-гормона, ГнРГ). Он представляет собой достаточно простой декапептид. Сначала носил название «ЛГРГ», но затем выяснилось, что он регулирует секрецию не только ЛГ, но и ФСГ. Как пояснил Сафар Исраилович, у человека присутствует в среднем лишь 1000–1500 ГнРГнейронов. Они вырабатывают ГнРГ, который попадает в систему воротных вен гипоталамо-гипофизарного аппарата. ГнРГ циркулирует в веночной сети гипоталамуса и гипофиза.
У женщин важную роль в регуляции менструального цикла играют пульссекреция и выбросы ГнРГ. У здоровых мужчин есть только один режим его секреции — пульс-секреция. За сутки происходит около 10–20 секреторных импульсов, и не существует пейсмейкеров, которые могли бы четко их регулировать. Секреция гонадотропинов (ЛГ и ФСГ) передней доли гипофиза стимулируется пульсирующим высвобождением ГнРГ и ингибируется высвобождением гонадотропин-ингибирующего гормона из гипоталамуса. ЛГ и ФСГ имеют общую a-субъединицу и отдельную ß-субъединицу. ЛГ стимулирует и повышает продукцию тестикулярного андрогена клетками Лейдига, а ФСГ стимулирует сперматогенез в клетках Сертоли [1–3].
ФСГ является полезным индикатором для оценки функционального состояния мужского герминогенного эпителия, хотя и далеким от совершенства. Несмотря на большой разброс нормативных показателей (1,4–18,1 МЕ/л), по мнению ряда авторов, значения данного гормона > 4,5 МЕ/л уже свидетельствуют о высоком риске нарушения сперматогенеза. Кроме того, нестимулированный ФСГ является плохим предиктором успешного хирургического лечения сперматозоидов у мужчин с необструктивной азооспермией (НОА) [4, 5].
В практике встречаются мутации рецепторов ФСГ и ЛГ. Мутации гена ФСГ-ß у мужчин неизменно приводят к азооспермии и уменьшению размеров яичек. По некоторым научным данным, имеющиеся мутации рецепторов ФСГ обеспечивают разной степени влияние на мужскую фертильность. При этом в зависимости от характера мутации выраженность изменений сперматогенеза может проявляться от тяжелой олигозооспермии до нормозооспермии с возможностью зачатия естественным способом. Эти клинические данные хорошо коррелируют с результатами экспериментальных работ, полученными на моделях мышей. Модели мышей с измененными ЛГ-рецепторами демонстрируют снижение уровня сывороточного и интратестикулярного тестостерона и возникновение позднего блока сперматогенеза [3, 6, 7].
Важным фактором в формировании фертильности является уровень тестостерона. В частности, большое проспективное когортное исследование 357 мужчин с идиопатическим бесплодием и 318 фертильных мужчин показало, что у бесплодных мужчин значительно снижены уровень общего и свободного тестостерона, соотношение тестостерон / ЛГ, а также тестостерон / эстрадиол (р < 0,001) [8].
К основным известным эндокринным регуляторам сперматогенеза относятся тестостерон (регулирует количество бледных сперматогоний, эффект на другие этапы сперматогенеза не доказан) и ФСГ (основной фактор, регулирующий все этапы сперматогенеза, кроме мейоза). С клинической точки зрения, синергизм тестостерона и ФСГ необходим для инициации и поддержания активного сперматогенеза [3].
Что касается андрогеновых рецепторов, иммуногистохимический анализ тканей яичка у бесплодных мужчин показал изолированное распространение андрогеновых рецепторов только на клетки Сертоли. Экспрессия этих рецепторов в клетках Сертоли и адекватные интратестикулярные концентрации тестостерона необходимы как для завершения мейоза половых клеток, так и для пролиферации сперматогоний. Повреждение андрогеновых рецепторов клеток Сертоли у мышей приводит к ранней остановке сперматогенеза. Недостаточная интратестикулярная концентрация тестостерона связана с нарушением целостности гематотестикулярного барьера у мышей. Увеличение дозы тестостерона и ФСГ способствует развитию in vitro герминальных клеток, полученных у мужчин с ранним и поздним блоком сперматогенеза, до сперматид, и это позволяет выполнить процедуру ISCI [9–12].
Исследования с аспирационной биопсией яичек у фертильных мужчин подтвердили, что тестостерон является преобладающим интратестикулярным андрогенным гормоном. Концентрация интратестикулярного тестостерона составляет 60 000 нг/дл, что намного выше, чем средняя концентрация сывороточного тестостерона у мужчин (500 нг/дл). В исследовании концентрация интратестикулярного тестостерона превышала концентрацию ГСПГ, что свидетельствует о том, что большая часть внутриклеточного тестостерона, вероятно, находится в биодоступной форме [13].
Используя новые методы анализа, те же авторы показали, что 70% всего интратестикулярного тестостерона составляет биологически активное вещество. При этом концентрация общего тестостерона сыворотки слабо коррелировала с концентрацией интратестикулярного тестостерона (р = 0,38). По данным новых тестов, сывороточные биоактивные андрогены также слабо коррелируют с интратестикулярным уровнем биологически активного андрогена (r = 0,46; p = 0,03).
Уровни сывороточного и интрастестикулярного тестостерона, измеренные одновременно, сильно коррелировали между собой в исследованиях (r = 0,67, p = 0,03). Кроме того, была обнаружена значительная вариабельность интратестикулярного уровня тестостерона, корая очень сильно коррелировала с сывороточным ЛГ (r = 0,87; p = 0,01). По мнению авторов, пульсирующая секреция ЛГ может отражать аналогично пульсирующую секрецию интратестикулярного тестостерона. Пульсирующая секреция интратестикулярного тестостерона была также подтверждена при оценке концентрации тестостерона и эстрадиола в канюлированных венах половых желез у мужчин с варикоцеле. Отбор проб каждые 15 мин выявил ежечасные импульсы тестостерона (3–5 импульсов в час) со средней амплитудой 176 +/– 42 нг/мл, что в 6,6 раза больше, чем надир. Вместе с тем сегодня влияние интратестикулярной пульсирующей секреции тестостерона на сперматогенез неизвестно [14]. Впрочем, та же экспериментальная работа показала, что сперматогенез в яичке сохраняется до тех пор, пока уровень интратестикулярного тестостерона не упадет ниже 75% от базовой концентрации. Однако четкий уровень интратестикулярного тестостерона, при котором сперматогенез человека нарушается, до конца не уточнен.
Многообещающим биомаркером интратестикулярного андрогенного статуса является инсулиноподобный белок — 3 (INSL3), который секретируется зрелыми клетками Лейдига. Аспирация яичек и анализ сыворотки крови подтвердили, что INSL3 тесно коррелирует с интратестикулярным тестостероном как во время индуцированного гипогонадизма, так и после лечения ХГЧ (r = 0,79, p < 0,001). При этом ингибин В и антимюллеров гормон не коррелировали с интратестикулярным тестостероном. Несмотря на эти многообещающие результаты, INSL3 еще не используется в рутинной клинической практике в качестве биомаркера функции клеток Лейдига и интратестикулярного андрогенного статуса [15].
Важным показателем степени сперматогенеза является ингибин В. В случае гипосперматогенеза его секреция снижается, а секреция ФСГ увеличивается. В одном проспективном исследовании было обнаружено, что ингибин В и ФСГ значительно коррелируют с основными показателями спермограммы. Вместе с тем значения коэффициента корреляции для ингибина В выше, чем для ФСГ (ингибин В: 0,48; р < 0,0001, ФСГ: 0,41; р = 0,0007) [16].
Противоположным действием обладает активин. Он является гетеродимером или гомодимером ß-субъединиц и также вырабатывается в семенниках. Активин оказывает агонистическое действие на секрецию ФСГ гипофизом, и его высвобождение ингилируется ингибином В. Активин в настоящее время не используют в клинической оценке мужской фертильности [17].
В 2001 г. был обнаружен пептид кисспептин. Он оказывает агонистическое действие на высвобождение ГнРГ и пульсирующее высвобождение ЛГ. Кисспептин был использован экспериментально у мужчин для индуцирования секреции гонадотропинов. Экспериментально показано, что введение кисспептина сопровождается более выраженным увеличением ЛГ, чем ФСГ. В настоящее время кисспептин не используется в клинической практике [18].
Эстрадиол вырабатывается из тестостерона с помощью ароматазы, входящей в семейство цитохромов Р450. Концентрация эстрадиола у мужчин в крови низкая, но чрезвычайно высокая в сперме, а его содержание в яичке может достигать 250 пг/мл, что выше, чем в сыворотке крови у женщин. По имеющимся научным данным, только использование тестостерона и эстрадиола приводит к снижению уровня ЛГ и ФСГ в сыворотке крови. Ингибирующий эффект эстрадиола на ЛГ оказывается за счет снижения чувствительности к ГнРГ. Дигидротестостерон, который не превращается в эстрадиол, не оказывал ингибирующий эффект на секрецию гонадотропинов [19, 20].
Для нормального сперматогенеза необходим достаточный уровень эстрадиола в яичке, что доказано клиническими исследованиями с участием бесплодных мужчин с врожденным дефицитом ароматазы. Рецепторы к эстрадиолу экспрессируются в клетках Сертоли и Лейдига, как и в герминальных клетках. Экспериментальные животные с поврежденным рецептором к эстрадиолу бесплодны и имеют аномальный сперматогенез. Эстроген снижает регуляцию связанных со сперматогенезом генов и индуцирует апоптоз сперматоцитов через эстрогеновые рецепторы 1 и 2. Эстроген регулирует реабсорбцию просветной жидкости в головке придатка яичка. По имеющимся данным, бесплодие у данной категории животных происходит за счет нарушения реабсорбции жидкости из проксимального отдела эпидидимиса и последующего повышения внутрипросветного давления. Данное открытие вызывает обеспокоенность по поводу потенциального прямого воздействия андрогенов окружающей среды на репродукцию самцов и сообщений по поводу снижения количества сперматозоидов у человека [21–23].
Также участвуют в репродукции ароматазы ферменты цитохрома Р450, который необратимо преобразует андрогены в эстрогены в различных тканях, включая яичко, печень, мозг и жировую клетчатку [21, 24]. В яичке ароматаза локализована в клетках Лейдига [25]. В большом ретроспективном когортном исследовании была обнаружена связь между бесплодием, основными параметрами спермы и сниженным соотношениям тестостерон/эстрадиол. Это соотношение < 10 было расценено как точка отсечения 20-го процентиля среди фертильных мужчин. В частности, подобное снижение соотношения тестостерон/эстрадиол наблюдается у тучных мужчин из-за повышенной периферической ароматизации [26].
Также клетки Сертоли экспрессируют рецепторы тиреоидиных гормонов. Помимо этого, тиреоидные гормоны влияют на развитие клеток Лейдига и стероидогенез. Таким образом, гормоны щитовидной железы могут поддерживать различные популяции половых клеток. Отмечается связь между тератозооспермией и наличием клинической картины гипер- или гипотиреоза [27, 28].
В физиологических условиях при резком повышении концентрации пролактина в крови может усилиться секреция тестостерона. Многие исследователи полагают, что связанный со сном пик секреции тестостерона у мужчин частично обусловлен увеличением содержания пролактина в плазме крови. При хронической гиперпролактинемии у мужчин ингибируются импульсные выбросы ГнРГ, и, следовательно, секреция гонадотропинов и уровень тестостерона в крови снижаются [29].
Как напомнил Сафар Исраилович, в организме присутствует несколько видов регуляции. Аутокринная регуляция — наличие рецепторов к ГнРГ, каннабиоидам и опиоидам в гипоталамусе. Паракринная регуляция — наличие рецепторов к ГнРГII и ЛГ, которые ретроградно поступают в гипоталамус посредством портального кровотока. Эндокринная регуляция — тестостерон и эстрадиол замыкают цепь отрицательной обратной связи на гипофизе и гипоталамусе соответственно.
К регуляторам активности ГнРГ-нейронов в целом относятся эстрадиол, прогестерон, дигидротестостерон, тестостерон, эстрадиол, кортизол, пролактин, гамма-аминомасляная кислота, активины и ингибины, эндоканнабиноиды, опиоиды, серотонин, лептин и мелатонин.
Гипогонадотропный гипогонадизм связан с дефицитом продукции ГнРГ и ЛГ/ФСГ. Бывает врожденным (с аносмией или без аносмии) и приобретенным (черепно-мозговые травмы, нейроинфекции, опухоли, операции). Очень редко встречается изолированный дефицит ЛГ (синдром Паскалини), казуистически редко — изолированный дефицит ФСГ [30].
Внутричерепные опухоли являются наиболее частой причиной приобретенных форм гипогонадотропного гипогонадизма. В отличие от приобретенных форм, этиология врожденного гипогонадотропного гипогонадизма более сложна и большинстве случаев носит идиопатический характер. Распространенность врожденного гипогонадотропного гипогонадизма у мужчин составляет 1/10000 [31].
До 90% случаев вторичного гипогонадизма не сопровождается признаками органического поражения яичек или других компонентов гипоталамо-гипофизарногонадной оси. Для этих ситуаций предложен термин «функциональный гипогонадизм» [32, 33]. До 85% мужчин с сексуальной дисфункцией при низком уровне тестостерона имеют признаки метаболического синдрома.
Перечень лекарственных препаратов, применяемых при гипогонадизме, достаточно широк:
- ингибиторы обратного захвата серотонина;
- антиаритмические препараты (амиодарон);
- антиконвульсанты (фенитоин);
- противогрибковые препараты (кетоконазол);
- опиаты;
- антипсихотики;
- статины в высоких дозах;
- тиазидные диуретики;
- спиронолактон;
- циметидин.
Для дифференциальной диагностики гипогонадотропного гипогонадизма от конституциональной формы задержки полового созревания необходимо учитывать результаты следующих тестов:
- физический осмотр;
- анализ кариотипа;
- определение уровня половых гормонов;
- тест с аналогом ГнРГ;
- определение костного возраста;
- МРТ гипоталамо-гипофизарной области.
Выделяется ряд главных целей и задач терапии гипогонадотропного гипогонадизма. Так, цели гормональной терапии в этом случае — поддержание функции яичек, развитие вторичных половых признаков, улучшение качества жизни и восстановление репродуктивной функции. Ключ к успеху лечения гипогонадотропного гипогонадизма — это выбор адекватного препарата с соответствующей дозой. Препараты тестостерона, гонадотропинов и ГнРГ с пульсирующей помпой могут использоваться в гормональной регуляции пациентов с гипогонадотропным гипогонадизмом. При необходимости сохранения репродуктивной функции у данной категории больных наиболее предпочтительны гонадотропины [34].
При терапии гипогонадотропного гипогонадизма ХГЧ 1000–1500 ед. 3 раза в неделю или по 2500 ед. 2 раза в неделю в течение 3–6 месяцев основными целями являются нормализация уровня тестостерона, переход темных А-клеток в бледные А-клетки и пролиферация пула герминальных клеток. При терапии ФСГ по 75– 150 ед. 3 раза в неделю (рекомбинантный, очищенный или в составе менопаузального гонадотропина) зона инъекции не должна совпадать с ХГЧ. ФСГ стимулирует превращение бледных А-клеток в В-клетки и последующий мейоз, инициирует сперматогенез [35].
Сперматогенез обычно восстанавливается за 6–9 месяцев, хотя у некоторых пациентов процесс может затянуться до двух лет. Примерно у 10% больных, несмотря на терапию с использованием ХГЧ и ФСГ, сперматогенез не восстанавливается вовсе [36]. Эффективность терапии не зависит от этиологии гипогонадотропного гипогонадизма: прогнозировать результат позволяет только объем яичек [37]. Пороговое значение объема яичек для прогнозирования эффективности терапии гонадотропинами — 4 см3 [38].
В частности, в исследовании 36 мужчин от 11 до 42 лет с гипогонадотропным гипогонадизмом (у 81% — первичный и у 19% — вторичный) практиковалась длительная терапия препаратами хорионического гонадотропина — от 12 до 240 месяцев (в среднем 56). Увеличение количества сперматозоидов среди больных с уменьшенными размерами яичек отмечено в 36% случаев, а при нормальных размерах яичек увеличение концентрации сперматозоидов отметили у 71% больных.
Некоторые авторы сегодня ошибочно считают, что ХГЧ является аналогом ЛГ. Это не так. В частности, олигосахаридные цепочки защищают ХГЧ от биодеградации. Также возможно развитие иммуноопосредованной резистентности к ХГЧ [39]. В целом, комбинированная терапия с применением ХГЧ и ФСГ позволяет добиться больших успехов, чем монотерапия. Среди побочных эффектов такого лечения отмечались акне и гинекомастия.
Согласно одному из доступных исследований десятилетнего опыта использования ХГЧ и МГЧ по отдельности и вместе для лечения больных гипогонадотропным гипогонадизмом, на фоне комбинированной терапии, по сравнению с ХГЧ, достоверно чаще отмечалось увеличение объема яичек (75 против 50% соответственно). У 86% пациентов, получавших комбинированное лечение, в конечном итоге удалось добиться сперматогенеза, по сравнению с 81% среди тех, кто получал только ХГЧ [40]. Примерно в 10% случаев гипогонадотропный гипогонадизм спонтанно разрешается после прекращения комбинированного лечения. Факторы риска неудачи лечения включают крипторхизм и маленький объем яичек (менее 4 мл).
Альтернативным способом стимуляции сперматогенеза у данной категории больных может являться инфузия ГнРГ в пульсирующем режиме. Хоффман и Кроули в 1982 г. использовали гонадорелин в качестве подкожной инфузии в импульсном режиме у пациентов с гипогонадотропным гипогонадизмом и добились у них индукции сперматогенеза [41, 42]. Также китайские исследователи в 2010 и 2011 гг. сообщили об успешном использовании импульсной подкожной инфузии ГнРГ для запуска сперматогенеза при гипогонадотропном гипогонадизме, однако размер выборки этих исследований был относительно небольшим [43, 44].
Пульс-терапия аналогами ГнРГ требует установки подкожной или венной помпы и имитирует естественную пульс-секрецию ГнРГ, при этом требуется регулярная смена канюли каждые 2–3 дня. Этот метод считается оправданным только при гипогонадотропном гипогонадизме с азооспермией. По сравнению с терапией ХГЧ+ФСГ, такой метод требует меньше времени для восстановления сперматогенеза, при нем наблюдается меньше пиков тестостерона, меньше частота развития акне и боли в грудных железах, однако выше частота местных кожных реакций [43].
В 2021 г. было предпринято рандомизированное контролируемое исследование CONSORT для сравнительной оценки эффективности гормональной терапии гипогонадотропного гипогонадизма в разных режимах с участием 220 пациентов. Участники были разделены на четыре группы. Группа 1 — ГнРГ при врожденном гипогонадотропном гипогонадизме, группа 2 — ГнРГ при приобретенном гипогонадотропном гипогонадизме, группа 3 — ХГЧ/МГЧ при врожденном гипогонадотропном гипогонадизме и группа 4 — ХГЧ/МГЧ при приобретенном гипогонадотропном гипогонадизме. Оценка эффективности производилась через 18 месяцев [45]. Группа ГнРГ получала подкожные инфузии гонадорелина в дозе от 100 до 500 мг в день с помощью специальной помпы — каждые 90 мин (16 импульсов за 24 ч). В зависимости от уровня ФСГ, ЛГ и тестостерона производилась корректировка дозы препарата. Симультанно были использованы раствор ХГЧ в дозе 5000 МЕ и МГЧ в дозе 75 МЕ. Доза МГЧ составила от 75 до 150 МЕ во внутримышечных инъекциях один или два раза в неделю. Доза ХГЧ — от 5000 до 10 000 МЕ внутримышечно один или два раза в неделю. Дозу препаратов корректировали в зависимости от уровня тестостерона и продуктивности сперматогенеза, причем уровень тестостерона поддерживался на отметке 10–15 нмоль/л. Авторы показали, что любой подход к терапии является эффективным: через 25 месяцев после начала терапии у 90% пациентов достигалось хотя бы минимальное присутствие сперматозоидов в эякуляте, однако концентрация сперматозоидов 10–15 млн/мл достигалась только у 50% мужчин. У пациентов, которые достигали более высоких пиковых уровней ЛГ на фоне терапии, частота получения сперматозоидов в эякуляте была выше.
В некоторых случаях больным могут назначаться селективные модуляторы рецепторов к эстрогенам (SERM), при этом частой ошибкой является бессмысленный прием таких препаратов, в частности кломифена. При истинном гипогонадотропном гипогонадизме отсутствует субстрат для активности SERM. В случае вторичного гипофизарного гипогонадизма отсутствуют гонадотрофы гипофиза, и нет клеток, способных синтезировать ЛГ и ФСГ. Гипоталамический гипогонадизм — «третичный», при нем нет смысла устранять отрицательную обратную связь, если нет положительного стимулирующего фактора (ГнРГ). Наконец, при гипогонадизме, ассоциированном с гиперпролактинемией, выработка ГнРГ не нормализуется, если не устранить избыточный уровень пролактина. При повышенном уровне пролактина, в частности, использование каберголина способно значительно улучшить гормональные показатели пациентов и помочь в восстановлении сексуальной функции [46].
В заключение Сафар Исраилович напомнил, что гипоталамо-гипофизарно-гонадная ось — это хрупкая структура, в функционирование которой лучше не вмешиваться без оснований и четкого понимания своих действий. Лучший способ лечения гипогонадизма у мужчин, не заинтересованных в сохранении фертильности, — тестостерон-заместительная терапия. Монотерапия ХГЧ в большинстве случаев, за некоторыми исключениями, неоправданна и сопряжена с рисками. Следует помнить, что для нормального сперматогенеза необзодимы и тестостерон, и ФСГ. Наконец, при гипогонадизме и эректильной дисфункции имеет смысл провести исследование на пролактин сыворотки крови.
Источники:
- Ubuka T et al. Front Endocrinol, 2014
- Kumasi TR. Cell Endocrinol, 2007
- Layman LC et al. J Clin Endocrinol, 2002
- Kwee J et al. Fertil Steril, 2008
- Ramasamy R et al. J Urol, 2013
- Kumar TR. Molec Cell Endocrinol, 2007
- Siegel ET et al. Reprod Sci, 2013
- Andersson AM et al. J Clin Endocrinol Metab, 2004
- Tesarik J et al. Fertil Steril, 2002
- Kato Y et al. Andrology, 2014
- De Gendt K et al. A Proc Nat Acad Sci USA, 2004
- Cheng CY et al. Prarmacol Rev, 2012
- Jarow JP et al. Ann NY Acad Sci, 2005
- Roth MY et al. J Androl, 2010
- Roth MY et al. Fertil Steril, 2013
- Meachem SJ et al. Eur J Endocrinol, 2001
- Hedger, MP et al. Mol Cell Endocrinol, 2012
- Skorupskaite K. Hum Reprod Upd, 2014
- Bagatell C et al. J Androl, 1994
- Hayes FJ et al. Clin Endocrinol Metab, 2000
- Carreau S et al. Adv Med Sci, 2012
- Hess RA et al. Nature, 1997
- Eddy EM et al., 1996
- Schlegel PN. Fertil Steril, 2012
- Inkster SJ. J Clin Endocrinol Metab, 1995
- Saylam B et al. Fertil Steril, 2011
- Mintziori G. Endocrinol Invest, 2016
- Kumar A. Indian J Endocrinol Metab, 2014
- Corsello SM et al. Clin Endocrinol, 2003
- Mao JF et al. Asian J Androl, 2017
- Varimo T et al. Hum Reprod, 2017
- Grossman, Matsumoto, 2017
- Corona, Maggi, 2015
- Lin et al. Medicine, 2019
- Arroyo et al., 2015
- Schiff et al., 2007
- Farhat et al., 2010
- Miyagawa Y, Tsujimura A. J Urol, 2005
- Leao, Esteves, 2014
- Yang L. Int Urol Nephrol, 2012
- Belchetz PE et al. Science, 1978
- Dwyer AA. Best Pract Rec Clin Endocrinol Metab, 2015
- Zhang GY. Reprod and Contracept, 2010
- Sun Y et al. Clin J Endocrinol Metab, 2011
- Lin et al. Medicine, 2019
- De Rosa M et al. J Clin Endocrinol Metab, 2004
Материал подготовила Шадеркина В.А. Видео можно посмотреть на Uro.TV
Комментарии
Для отправки комментариев необходимо войти или зарегистрироваться
Как проводится оценка результатов мазка на флору у мужчин?
В материале из мазка могут быть следующие компоненты:
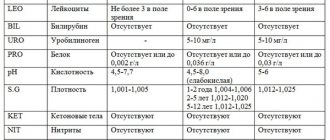
- Лейкоциты – в мазке у мужчин во множественном количестве они являются признаком воспаления и говорят об уретрите или простатите. В норме в мазке не должно быть больше 5 лейкоцитов в поле зрения.
- Эпителий – это клетки слизистой оболочки уретры. В норме допускается 5–10 клеток в поле зрения. Большее их количество говорит о воспалении.
- Слизь – в большом количестве бывает при воспалительных процессах.
- Кокки – небольшое их число допустимо в норме, так как они входят в состав нормальной микрофлоры слизистой оболочки. Много кокков в поле зрения является признаком уретрита.
- Гонококки, трихомонады, уреаплазмы, хламидии и другие бактерии, простейшие – в норме в мазке отсутствуют. При их нахождении ставится диагноз соответствующего заболевания, передающегося половым путем.
В некоторых случаях (например, при хроническом простатите) перед сдачей мазка на флору проводится массаж простаты через прямую кишку.
Эксперт: Дмитрий Гришин, врач-уролог Автор: Екатерина Хрипунова
Симптоматика
Симптомы, которые являются показательными для обязательного назначения мазка:
- Ощущения боли, тяжести и дискомфорта, наблюдаемые у мужчин в области половых органов.
- Жалобы на жжение и зуд в мочеиспускательном канале.
- Появление сыпи на половом члене.
- Учащенное, болезненное мочеиспускание и другие связанные с ним проблемы.
- Наблюдение патологических выделений из уретры.
- Появление отечности в области половых органов и паха, появление выделений из полового члена или крови в моче и сперме.
При наличии неприятных симптомов следует незамедлительно посетить врача, сдать мазок и сделать анализ на наличие половых инфекций. Что означает эпителий в мазке, зависит от особенностей его клеток и их структуры и количества.
Для чего выявляется цилиндрический эпителий в мазке у мужчин? Об этом мы расскажем вам далее.
Что определяют посредством мазка из уретры? Различные венерические заболевания, присутствие болезнетворных микроорганизмов, прогрессирование воспалительного процесса.