Ученые утверждают, что бактерии существуют на Земле как минимум 3,8х109 лет, в то время как антибиотики используются в клинической практике лишь с 40‑х годов прошлого века [1]. Но и этого времени хватило, чтобы препараты указанной группы обросли множеством мифов, которые мешают эффективной антибиотикотерапии. Несмотря на то что лечение антимикробными средствами априори невозможно без непосредственного руководства врача, современный «пациент разумный», подверженный влиянию околонаучных данных, вносит свой «неоценимый вклад» в дело антибиотикорезистентности и прочих негативных последствий некорректного применения антибиотиков. Предостеречь его от опрометчивых решений может грамотный фармспециалист, который владеет корректной информацией об антимикробных средствах и готов поделиться ею с клиентом.
Миф. Современные антибиотики настолько «сильные», что перед ними не устоит ни одна бактерия
Правда.
На самом деле одной из самых актуальных проблем современной фармакологии и здравоохранения в целом является стремительное развитие резистентных штаммов бактерий, устойчивых в том числе и к современным антибиотикам последних поколений. Возникновение устойчивости зарегистрировано к каждому без исключения классу антимикробных препаратов. Она может развиваться на любом этапе достижения терапевтического эффекта (и даже на нескольких сразу). Основные механизмы развития устойчивости [1, 2]:
- Изначально устойчивые штаммы. Например, некоторые грамотрицательные бактерии имеют наружные клеточные мембраны, защищающие их клетки от действия ряда пенициллинов и цефалоспоринов.
- Спонтанные мутации, приводящие к появлению организмов, устойчивых к антибиотикам.
- Передача генов устойчивости к антимикробным препаратам — самый распространенный и важный механизм развития антибиотикорезистентности.
Устойчивость к антибиотикам — глобальная проблема, которая может иметь непредсказуемые последствия для каждого из нас. Увы, но огромный вклад в ее существование вносят сами потребители. Об этом уместно напомнить покупателям с рецептами на антибиотики, подчеркнув, что существенно снизить риски развития устойчивых штаммов позволяет прием антимикробных препаратов только по назначению врача и четкое соблюдение дозы и режима антибиотикотерапии.
Миф. Чтобы вылечиться побыстрее, нужны «сильные» антибиотики широкого спектра действия
Правда.
Все зарегистрированные антибактериальные препараты можно смело относить к мощным, то есть «сильным», однако выраженность их противомикробного эффекта зависит от множества факторов, объединенных принципами антибиотикотерапии [2]:
- Установка диагноза настолько точная, насколько это возможно. Знание диагноза позволяет определить предполагаемого возбудителя.
- Определение возбудителя, если это возможно.
- Принятие взвешенного решения о необходимости назначения антибиотиков.
- Подбор оптимального антибиотика с учетом фармакокинетики и спектра активности.
- Подбор оптимальной дозы и курса лечения (последний при большинстве острых инфекций должен составлять не менее 5–10 дней).
- Контроль эффективности антибиотикотерапии.
В российских реалиях, когда контроль за приемом антибиотиков, откровенно говоря, недостаточен, особенно остро стоит вопрос некорректного подбора препаратов. Известно, что его осуществляют двумя способами: этиотропным и эмпирическим. В первом случае антибиотик применяется целенаправленно против определенного, точно установленного возбудителя. Без сомнения, это рационально и оправданно. Однако идентификация микроорганизма, вызвавшего инфекцию, требует времени, обычно это занимает несколько суток. Когда процесс протекает остро и больному требуется немедленная помощь, выделение возбудителя — неоправданная роскошь. В такой ситуации назначают эмпирическую терапию, подбирая препарат с учетом наиболее вероятных возбудителей [3]. Например, самый частый возбудитель пневмонии — пневмококк, цистита — кишечная палочка и так далее.
Если антибиотик был подобран корректно и все остальные принципы антибиотикотерапии были соблюдены, он, без сомнения, окажется «сильным». А вот тот же препарат, применяемый неправильно (независимо от того, на каком этапе была сделана ошибка), может проявить «слабость» и не оказать терапевтического действия.
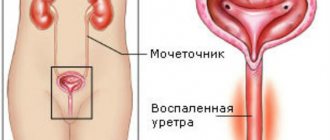
Одной из наиболее актуальных проблем детской нефрологии и в целом педиатрии в настоящее время остается своевременная диагностика и рациональная терапия инфекции мочевыводящих путей (ИМВП).
Под данным термином подразумевают рост бактерий в мочевом тракте, способный приводить к развитию воспалительного процесса.
В зависимости от локализации воспалительного процесса различают:
- Острый пиелонефрит – воспалительное заболевание почечной паренхимы и лоханки, возникшее вследствие бактериальной инфекции.
- Острый цистит – воспалительное заболевание мочевого пузыря бактериального происхождения.
- Уросепсис – процесс, характеризующийся развитием бактериемии с входными воротами в мочевыводящих путях и обнаружением типичного для ИМВП микроорганизма.
В соответствии с современными международными представлениями диагноз «хронический пиелонефрит» правомочен только при наличии повреждения почек в виде фиброза и деформации чашечно-лоханочной системы в результате повторных атак ИМВП [1, 2]. Как правило, такие структурные изменения возникают при повторных атаках воспалительного процесса в мочевом тракте, развивающиеся на фоне нарушения уродинамики, обусловленного анатомическими аномалиями мочевыводящего тракта или обструкцией, и подтверждаются визуализационными методами диагностики (ультразвуковое исследование, урография, магнитно-резонансная урография) [3].
Повторные же эпизоды воспалительного процесса в почках и мочевыводящих путях следует рассматривать как случаи реинфицирования стерильных мочевых путей (в норме).
Распространенность ИМВП в детском возрасте составляет около 18–20 случаев на 1000 детского населения. Частота развития инфекции мочевых путей зависит от возраста и пола, при этом чаще страдают дети первого года жизни. До 3-месячного возраста ИМВП чаще встречается у мальчиков, в более старшем возрасте – у девочек. В младшем школьном возрасте инфекция мочевыводящих путей диагностируется в среднем у 7,8% девочек и у 1,6% мальчиков.
По данным различных исследований, выявляется следующая средняя частота рецидивов ИМВП в детском возрасте:
- девочки – у 30% в течение 1-го года после первого эпизода, у 50% в течение 5 лет после первого эпизода;
- мальчики – у 15–20% в течение года после первого эпизода [4, 5].
Следовательно, основные принципы терапии инфекции мочевыводящих путей заключаются в следующем:
- Купирование острого воспалительного процесса.
- Профилактика рецидивирующего течения инфекции.
Показания к госпитализации детей с данным диагнозом:
- Ранний возраст ребенка (младше 2 лет при наличии фебрильной лихорадки, дети первого месяца жизни даже в отсутствие гипертермии);
- Наличие симптомов дегидратации, интоксикации при неэффективности пероральной регидратации или отсутствии возможности ее проведения;
- Подозрение на наличие септического состояния;
- Наличие повторной рвоты.
У детей с симптоматикой инфекции мочевой системы немедленно должна быть начата антибиотикотерапия. Перед началом лечения рекомендовано собрать мочу для исследования на стерильность с целью выявления микробного агента и определения чувствительности возбудителя к антибиотику [6, 7]. Однако на практике часто трудно на ранних этапах болезни установить вид бактерии и тем более определить ее чувствительность к различным группам антибиотиков. Поэтому общепринятым считается назначение имперической терапии препаратами широкого спектра действия. К препаратам выбора относятся амоксициллин и «защищенные» пенициллины (амоксициллин+клавулановая кислота), а также цефалоспорины II–III поколений [8, 9].
У новорожденных и детей с септицемией, рвотой и выраженными симптомами интоксикации антибиотик начинают вводить парентерально (табл. 1) с последующим после стабилизации состояния переходом на пероральный прием лекарственного препарата (табл. 2). В отсутствие данных критических симптомов изначально применяется пероральная терапия.
Как препараты резерва, а также для комбинированной терапии при уросепсисе могут быть использованы аминогликозиды (амикацин 20 мг/кг/сут 1 раз в день, тобрамицин 5 мг/кг/сут 3 раза в день, гентамицин 5–7,5 мг/кг/сут 3 раза в день). Детям старше 12 лет допустимо назначение карбопенемов и фторхинолонов.
Антибактериальная терапия в течение 10–14 дней обычно ликвидирует инфекцию независимо от ее локализации. У детей с циститом препаратами выбора чаще являются фуразидин и ко-тримоксазол. Прием антимикробной терапии таких пациентов в течение 3–5 дней оказывается достаточным. При этом следует помнить, что проведение антибактериальной терапии длительностью менее 3 дней не рекомендуется.
При рецидиве ИМВП, как и при 1-м эпизоде, показана антибактериальная терапия с той же продолжительностью курса.
С целью предупреждения реинфекции и сморщивания почки по показаниям проводится антимикробная профилактика (табл. 3). Данный метод основан на постоянном применении низких доз антимикробного препарата (обычно 25% от терапевтической дозы), применяемых однократно на ночь [10].
Показания к проведению профилактического лечения:
- наличие пузырно-мочеточникового рефлюкса;
- рецидивы инфекции мочевыводящих путей;
- тяжелые аномалии мочевого тракта до хирургической коррекции.
Длительность профилактического курса избирается индивидуально, обычно он составляет не менее 6 месяцев. Фитотерапия при инфекции мочевыводящих путей достаточно популярна в нашей стране. Данный метод лечения может быть использован в качестве поддерживающего лечения (после проведенного курса антибактериальной терапии) или для профилактики повторных рецидивов.
Следует помнить, что педиатр и детский нефролог должны обращать пристальное внимание родителей на соблюдение правил личной гигиены, контроль за регулярностью опорожнения мочевого пузыря и кишечника, а также за достаточным потреблением жидкости ребенком.
При проведении адекватного лечения большинство случаев острой инфекции мочевыводящих путей заканчивается выздоровлением. При рецидивирующем течении ИМВП, а также наличии структурных аномалий мочевого тракта, в первую очередь пузырно-мочеточникового рефлюкса, в 10–20% случаев отмечается прогрессивное развитие склеротических изменений в почечной ткани, что требует регулярного контроля почечных функций и своевременного назначения нефропротективной терапии [11].
Миф. Пероральные цефалоспорины такие же «сильные», как и парентеральные
Цефалоспорины (ЦС) — один из самых обширных классов антимикробных препаратов, представленных как в пероральной, так и парентеральной форме. При этом выраженность антибактериального эффекта в первую очередь определяется принадлежностью к одному из четырех поколений. Антибиотики цефалоспорины 1 поколения — парентеральный цефазолин и пероральный цефалексин — имеют самый узкий спектр активности, схожий со спектром аминопенициллинов (ампициллина, амоксициллина) [3]. Цефалоспорины II поколения (парентеральный цефуроксим, пероральный цефаклор) активны в отношении грамотрицательных бактерий, при этом по действию на стафилококки и стрептококки они близки к предшественникам. Таким образом, мощность представителей антибиотиков первого и второго поколений практически не зависит от лекарственной формы. Но с цефалоспоринами последующих поколений всё не так просто.
Известно, что антибиотики 3 поколения обладают более высокой по сравнению с ЦС-I и ЦС-II активностью в отношении грамотрицательных бактерий, пневмококков и стрептококков. Однако их пероральные формы цефиксим и цефтибутен определенно обладают более узким спектром активности, чем парентеральные цефтриаксон, цефтазидим и цефоперазон. В частности, препараты для приема внутрь не действуют в отношении пенициллинорезистентных пневмококков, что связывают с их относительно невысокой биодоступностью. Так, биодоступность цефиксима составляет всего 40–50 %, в то время как у парентеральных форм она приближается к 100 % [3].
Тем не менее, цефиксим считается мощным антибиотиком, применение которого оправдано при инфекциях мочевыводящих путей, а также среднем отите и фарингите. Цефтибутен применяют гораздо реже: он показан только для терапии острых бактериальных осложнений хронического бронхита, среднего отита, фарингита и тонзиллита. Существенный недостаток этого препарата — низкая активность в отношении золотистого стафилококка [4]. В то же время парентеральные цефалоспорины третьего поколения широко применяются для лечения тяжелых инфекций верхних, нижних дыхательных путей, желчевыводящих путей, мягких тканей, кишечных инфекций, сепсиса и других [3].
При каких ЗППП принимают антибиотики
Антибиотики эффективны только в отношении заболеваний, вызванных бактериями – гонореи, сифилиса, хламидиоза, трихомониаза, венерического лимфогранулематоза, СПИДа. Однако против вирусов, грибков или паразитов они бессильны.
Сложность подбора терапии заключается в трудности определения возбудителя. Возникновение некоторых венерических заболеваний, например, болезни Рейтера, связывают с перенесёнными инфекциями – гонореей и хламидиозом, но однозначно определить принадлежность к определённому типу учёным пока не удалось.
Миф. Хлорамфеникол — «сильный» безопасный антибиотик при кишечных инфекциях
Правда.
С одной стороны, хлорамфеникол действительно имеет широкий спектр активности, включающий грамположительные и грамотрицательные кокки, грамотрицательные палочки, в том числе кишечную и гемофильную, а также других возбудителей кишечных инфекций — сальмонелл, шигелл и так далее. Но, с другой стороны, препарат связан с не менее широким спектром неблагоприятных реакций.
Известно, что хлорамфеникол угнетает кроветворение, вызывая тромбоцитопению, анемию и даже фатальную апластическую анемию (хотя и всего в 1 случае на 10 000–40 000 пациентов) [3]. Кроме того, он оказывает гепатотоксическое, нейротоксическое действие и проявляет другие побочные эффекты. Ввиду крайне неблагоприятного профиля безопасности хлорамфеникол считается антибиотиком резерва и назначается исключительно в случаях, когда польза от его применения превышает риск побочных эффектов. Это происходит, как правило, если по каким‑то причинам не удается подобрать другой препарат антибактериального действия [3, 5].
Группы антибиотиков от половых инфекций
При составлении схемы лечения венерологических заболеваний принято ориентироваться на фармакологические свойства антибиотиков. Только несколько препаратов можно назвать универсальными – это макролиды Эритромицин и Азитромицин. Остальные поражают только конкретного возбудителя либо принимаются в сочетании с другими лекарствами.
Пенициллины
Основа противосифилисной терапии. Пенициллин G короткого действия используется во всём мире как максимально эффективное средство на любой стадии заболевания.
Природные пенициллины, такие как Бензилпенициллин, оказывают непродолжительное действие, разрушаются в кислой среде желудка, поэтому выпускаются только в виде инъекций. Чтобы уменьшить кратность введения, используют синтетические антибиотики Тикарциллин, Карфециллин, которые отличаются более высокой биологической активностью.
Макролиды
Практически не имеют побочных эффектов, поэтому при невозможности применения пенициллинов и других антибиотиков легко замещают их. Подходят для лечения гонореи, сифилиса, в том числе сочетанных с хламидиозом.
Эритромицин и Азитромицин назначают, если антибиотиковая терапия после нескольких курсов не дала результата.
Тетрациклины
Тетрациклин, Доксициклин – высокотоксичные средства, но в отдельных случаях включаются в лечебный курс по уничтожению бактерий бледной трепонемы и хламидий. Переносятся тяжело – вызывают аллергию, провоцируют повышение внутричерепного давления, нарушение работы ЖКТ, поэтому желательно вводить их внутривенно.
Фторхинолоны
Препараты Норфлоксацин, Офлоксацин переносятся лучше, чем тетрациклины, поэтому их включают в схему при длительном лечении. Эффективны в отношении гонококковой инфекции (гонореи), урогенитального хламидиоза. Выпускаются в виде таблеток и инъекций.
Аминогликозиды
Спектиномицин, Неомицин оказывают бактерицидное действие независимо от фазы размножения бактерий, поэтому их целесообразно применять как при отсутствии симптомов заболевания, так и при тяжёлых формах, при угнетённом иммунитете. Принимаются при гонорее: мужчины – 1 раз, женщины – 2 раза (доза равна 2 г).
Цефалоспорины
Обладают мощным бактерицидным действием, аналогичным тому, какой дают пенициллины. Несмотря на схожесть механизма воздействия на клетки бактерий лекарства нового поколения Цефпиром, Цефтаролин значительно более активны, поэтому в венерологии используются для лечения любых форм гонореи и сифилиса.
Производные нитроимидазола
Метронидазол, Орнидазол назначаются при трихомониазе. Умеренно токсичны, выпускаются в форме вагинальных свечей и таблеток для приёма внутрь. Во время лечебного курса запрещено употреблять алкогольные напитки.
Миф. Тетрациклины традиционно «слабые» антибиотики, значительно менее мощные, чем пенициллины
Правда.
На самом деле тетрациклины имеют широкий спектр антибактериальной активности, причем современные их представители действуют в отношении еще большего количества бактерий, чем их предшественники, включая ряд возбудителей, устойчивых к другим классам антибиотиков. Так, тигециклин, появившийся на рынке только в середине 2000‑х, был разработан в рамках программы по борьбе с растущей антибиотикорезистентностью таких «сложных» в этом плане возбудителей, как золотистый стафилококк и кишечная палочка [6].
Тетрациклины, в том числе и применяемые на протяжении десятилетий тетрациклин и доксициклин, способны проникать внутрь клетки, поэтому они и сегодня широко применяются для лечения внутриклеточных инфекций, передающихся половым путем (хламидиоза, уреаплазмоза, микоплазмоза). К показаниям к их назначению относится и хеликобактерная инфекция — в составе эрадикационной терапии. Благодаря эффективности в отношении Propionibacterium acne
тетрациклины наряду с макролидами применяются для лечения угревой болезни. Миноциклин, чей спектр включает
Neisseria meningitidis
, используется для профилактики менингококковой инфекции [2].
В качестве ложки дегтя следует упомянуть и о том, что для большинства тетрациклинов (за исключением современных представителей) свойственны высокий уровень вторичной резистентности многих бактерий и к тому же перекрестная устойчивость микроорганизмов [3]. И это, несомненно, во многих случаях снижает их актуальность.