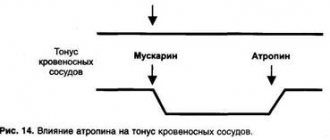
Нейропротекторы в лечении глаукомы – обзор препаратов
Нейропротекторы при лечении глаукомы стадии использовать не так давно. При этом препараты защищают сетчатку и зрительный нерв. Этот тип терапии направлен на коррекцию метаболических нарушений, улучшении микроциркуляции, питания тканей, нормализацию реологических свойств крови, налаживание основного и латерального кровообращения.
Следует отметить, что эта методика эффективна только при снижении уровня внутриглазного давления путем медикаметнозной терапии, лазерного и хирургического лечения.
Классификация
Существует четыре степени изменения нервных волокон при глаукоме:
- Безвозвратно погибшие;
- Острая фаза дегенерации;
- Дистрофические изменения;
- Сохранная структура.
Нейропротекторы делят на две группы:
- Прямые непосредственно защищают нейроны и волокна сетчатки и зрительного нерва, соответственно.
- Непрямые нейропротекторы повышают устойчивость организма к снижению реперфузионого давления.
Подбор конкретной противоглаукомной терапии требует от врача системного обследования пациента. Он проводится на основании гемодинамических нарушений, метаболических сдвигов. Контролировать эффективность лечения нужно каждые полгода. Ниже представлены основные группы нейропротекторов.
Блокаторы кальциевых каналов
Препараты этой группы повышают устойчивость клеток к ишемическому воздействию, а также расширяют сосуды. Чаще всего используют бетаксолол. Это лекарство снижает сосудистое сопротивление и повышает устойчивость нейронов. За счет хорошей проницаемости, активное вещество быстро проникает в структуры глаза и уже в первый час после инстилляции действует на рецепторы.
Чтобы снизить уровень давления внутри глаза бетаксолол закапывают дважды в сутки, но иногда кратность увеличивают до 3-4 раз.
Противопоказано назначение этого лекарства пациентам с нарушением работы и ритма сердца, дистрофией роговицы, а также при гиперчуствительности. Пациенты с сахарным диабетом, тиреотоксикозом, мышечной слабостью, синдромом Рейно должны соблюдать осторожность. То же касается и беременных женщин. Перед плановой общей анестезией желательно отменить препарат.
На фоне терапии контролировать состояние глаз (продукция слезной жидкости, целостность эпителия) нужно хотя бы раз в полгода.
При местном использовании бетаксолола развитие системных побочных эффектов маловероятно.
Препараты, которые содержат бетаксолол в качестве действующего вещества:
- Бетоптик (0,5% раствор);
- Беоптик С (0,25% раствор).
Ферментные антиоксиданты
Супероксиддисмутаза относится к природным антиоксидантным защитникам организма. Он разрушает активные формы кислорода и оказывает противовоспалительное действие. За счет этого тормозится развитие деградации в структурах трабекулярной сети и волокнах зрительного нерва.
Уже через 1-2 часа после закапывания определяется максимальная концентрация препарата в тканях глаза. Он проникает в сосудистую оболочку и сетчатку, накапливаясь в них.
Назначают препарат 5-6 раз в сутки. Иногда пользуются методикой форсированных инстилляций, когда в течение часа препарат закапывают каждые 10 минут. Курс лечения составляет 2 месяца.
Препараты, выпускаемые различными производителями:
- Эрисод. Представляет собой лиофилизированный порошок (400 тысяч и 1,6 миллиона единиц), из которого готовят капли для глаз.
- Рексод (800 тысяч единиц).
Неферментные антиоксиданты
Гистохром может нейтрализовать ионы железа, которые обычно накапливаются в зоне ишемии.
Также он перезватывает свободные радикалы, улучшает энергетический обмен и нормализует реологические свойства крови. Максимальная концентрация препарата достигается спустя час после введения.
Пути введения лекарства включают субконъюнктивальный т прбульбарный. Продолжительность курса терапии составляет 10 инъекций.
Препарат Гистохром выпускается в виде 0,02% раствора в ампулах.
Янтарная кислота положительным образом влияет на метаболические процессы. При этом снижается ионная проницаемость мембраны, регулируется кальциевый обмен и т.д. соли этой кислоты являются составляющими многих БАДов (митомин, янтавит, энерлит).
Сукцинатсодержащие гетероциклические соединения (например, мексидол) являются более перспективными лекарствами. Этот препарат образует буферную окислительно-восстановительную систему. Он положительно влияет на энергетические процессы в клетках, активизирует синтез нуклеиновых кислот, усиливает гликолиз. Мексидол улучшает кровоток в зоне ишемии и способствует скорейшему заживлению дефектов.
Мексидол нельзя назначать при гиперчувствительности или в случае серьезных заболеваний печени и почек. Среди побочных эффектов чаще проявляются диспепсия, сухость во рту и аллергия.
Вводят мексидол внутримышечно (100 мг) дважды в сутки. Курс терапии составляет 10-14 дней. Препарат выпускается в виде 5% раствора.
Эмоксипин является одним из наиболее старых препаратов для лечения заболеваний глаз, сопровождающихся ишемией. Это вещество является структурным аналогом витамина В6. Препарат стабилизирует мембрану эритроцитов, играет важную роль при нарушении микроциркуляции. Максимальная концентрация наблюдается через 15-30 минут, при этом происходит накопление вещества в клетках сетчатки.
При лечении эмоксипином требуется контроль коагулограммы крови. Нельзя смешивать лекарство в одном шприце с другими препаратами. Эффективность лечения повышается, если одновременно внутрь принимать альфа-токоферол.
Эмокипин можно вводить путем инстилляции, приокулярных инъекций или в виде глазной пленки. Кратность закапываний обычно составляет 5-6 аз в сутки. Курс лечения достигает 2-4 недель.
Препарат выпускается виде 1% раствора или глазных пленок.
Нейропептиды
Цитомедины представляют собой щелочные полипептиды. Путем кислотной экстракции их очищают от примесей. Эти вещества стимулируют процессы дифференцировки клеток, влиют на гуморальный и клеточный иммунитет, гемостаз, микроциркуляцию.
Цитомедины, которые получают из тканей головного мозга, сетчатки, участвуют в регуляции нервной ткани. Сейчас в офтальмологии применяют кортексин и ретиналамин.
Ретиналамин вводят внутримышечно, парабульбарно (один раз в сутки), кортексин вводят только внутримышечно. Курс терапии продолжается 10 суток.
Чтобы улучшить гемодинамику, можно использовать ангиопротекторы и спазмолитики.
Спазмолитики
В клинической практике используют пуриновые и индольные алколоиды. Они повышают концентрацию цАМФ в стенке сосудов, угнетают агрегацию тромбоцитов.
Обычно назначают Теофиллин (250 мг трижды в сутки) или ксантинола никотинат (150 мг трижды в день).
К индольным алколоидам относят винпоцетин (принимают внутрь по 5 мг трижды в сутки). Для повышения эффективности курс можно начать с внутривенного введения.
Пуриновые алколоиды включают курантил, трентал. Они улучшают реологические свойства крови при ежедневном применении.
Ангиопротекторы
Эти лекарства нормализуют микроциркуляцию, сосудистую проницаемость, устранят отеки тканей, связанных с нарушением проницаемости сосудистой стенки, снижают активность плазматических кининов и стимулируют метаболические процессы. В практике используют доксиум, пармидин, этамзилат.
Корректировать метаболические нарушения помогают витамины и ноотропы.
Ноотропные средства
Чаще всего из этой группы препаратов назначают пирацетам, который улучшает микроцикуляцию, метаболические процессы и повышает утилизацию глюкозы. Противопоказано назначение препарата при выраженной почечной недостаточности, геморрагическом инсульте, гиперчувствительности.
Назначат лекарство внутрь по 30-160 мг/кг/сутки. Курс терапии составляет 6-8 недель.
Также в арсенале врача имеются комбинированные средства, содержащие пирацетам и циннаризин. Назначают лекарство по 1-2 капсулы трижды в сутки. Курс терапии составляет 1-3 месяцев.
Также используют производные гамма-аминомасляной кислоты (пикамелон). Он обладает сосудорасширяющим и ноотропным действием. Другим аналогом ГАМК явояется нооклерин.
Препарат Семакс является аналогом АКТГ. Он улучшает энергетический обмен в нейронах, повышает устойчивость их к гипоксии и повреждению. Его закапывают в нос, откуда он всасывается в системный кровоток через сосуды слизистой оболочки. Продолжительность лечения составляет 5-14 дней. Также препарат используют для эндоназального электрофореза (Семакс вводят с анода).
Источник: https://glaucomacentr.ru/vse-o-glaukome/344-nejroprotektory-pri-glaukome
Восстановление зрения — самостоятельное восстановление зрения без операции
Веселовская З.Ф., Веселовская Н.Н. Primary neuroprote ction in glaucoma Z.F. Veselovskaya, N.N. Veselovskaya
Kiev City Ophthalmological Center Department of Ophthalmology of Kiev State Medical University, Kiev Purpose: to study efficiency of calcium channel blocker (CCB) agents in glaucoma treatment. Materials and methods: Patients with early glaucoma participated in the trial. Ophthalmologic examination consisted of testing of visual acuity, perimetry, tonometry, pachymetry, OCT. Also biochemical blood assay was taken, and observation was also carried out by cardiologists, neurologist and internal medicine specialist. In the main group amlodipine was prescribed by 5 mg per day, betaxolol ophthalmic solution and travoprost ophthalmic solution. In control group travoprost was used as hypotensive agent. Observation lasted 3 years. Results: 63 patients with newly diagnosed POAG were taken into 1 sample, 43 — in to the second one. In both groups IOP level decreased by 20-25% from the baseline. All examined indices were stable in the main group during all observation period. Worsening of all functional indices without visual loss was registered in the 2nd group. Conclusion: CCB agents have evident neuroprotective effect and could be recommended for usage in complex treatment of patients with glaucoma.
Актуальность Анализ современной статистики инвалидности по зрению вследствие глаукомы свидетельствует о том, что в последние 20 лет зрение на один глаз потеряли около 27%, а на оба — около 9% больных глаукомой. Даже применение гипотензивной терапии кардинально не влияет на ситуацию в целом, поскольку двухсторонняя слепота на фоне лечения регистрируется у 4,4% пациентов с глаукомой. Таким образом, нормализация ВГД не является гарантией достижения стабильного уровня зрительных функций. Такая ситуация не может не настораживать офтальмологов всего мира. Сегодня они объединяют усилия по достижению консенсуса в вопросах патогенеза, диагностики и лечения глаукомы. Активно ведутся многосторонние исследования по поиску оптимальных путей решения этой серьезной проблемы. При этом, согласно рекомендациям Европейского глаукомного общества и мировым стандартам, предусматривается сохранение достаточно высокого качества жизни больных глаукомой как можно дольше. В настоящее время не вызывает сомнения, что прогрессирование оптической нейропатии при глаукоме связано с сосудистой дисрегуляцией локального и системного уровня, реологическими и другими обменными нарушениями, в результате которых и возникают хроническая ишемия и гипоксия. Нейрофизиологические исследования показали, что избыточное выделение глютамата в условиях ишемии оказывает нейротоксический эффект за счет неконтролируемого входа ионов кальция в нервную клетку через ионные кальциевые каналы ее соматической мембраны. Нейродистрофическая природа оптической глаукомной нейропатии обусловливает необходимость поиска эффективных фармакологических препаратов, обладающих нейропротекторными свойствами. Оценка эффективности нейропротекторного лечения представляет определенные сложности, поскольку его результаты можно увидеть только по истечении достаточно большого промежутка времени. Нейрофизиологические исследования последних лет позволили выделить фармакологические препараты, обладающие прямыми и непрямыми нейропротекторными свойствами. Установлено, что прямой нейропротекторный эффект реализуется только на уровне неврального синапса, т.е. соматических мембран входящих в него нервных клеток. Сегодня доказано, что таким действием обладают блокаторы кальциевых каналов (БКК) и блокаторы НМДА-рецепторов (БНМДА). Так, БКК (Бетоптик С, норваск, амлодипин и др.) блокируют кальциевые каналы пресинаптической мембраны, препятствуют избыточному входу ионов кальция внутрь терминали аксона и избыточному выбросу нейромедиатора глютамата в синаптическую щель. БНМДА (мамонтин и др.) связывают хемоуправляемые глютаматом ионные каналы постсинаптической мембраны, препятствуя избыточному входу ионов кальция в нервную клетку. Препараты группы БКК сегодня широко известны в кардиологической и неврологической практике. Выра-жен-ное действие БКК связано с тем, что прямые нейропротекторные свойства (блокада кальциевых каналов соматической мембраны нервных клеток) усиливаются еще и вазоселективными, или непрямыми нейропротекторными свойствами путем блокады кальциевых каналов соматической мембраны гладкомышечных клеток сосудистой стенки. Результаты нашего совместного проекта с Институ-том физиологии им. А.А. Богомольца НАН Украины (1999-2007) доказали, что БКК обладают не только нейропротекторными, но и выраженными нейроретинопротекторными свойствами за счет регуляции потока ионов Са2+ через ионные высокопороговые кальциевые каналы соматической мембраны ганглиозных клеток и терминали аксона, создавая барьер для развития нейротоксического повреждения ганглиозных клеток в условиях хронической ишемии [5,6,13,14]. Цель Изучить эффективность фармакологических препаратов из группы блокаторов кальциевых каналов в комплексном лечении больных глаукомой. Материалы и методы Всего в течение 3-х лет (регулярное обследование 1 раз в квартал) под контролем находилось 63 пациента (33 — с ПОУГ и 30 — с НТГ). Контрольную группу II составили 43 пациента (23 — с ПОУГ и 20 — с НТГ). В исследованные группы были включены пациенты только с впервые выявленной глаукомой. Офтальмологическое обследование включало определение остроты зрении (ОЗ), поля зрения (ПЗ) методом компьютерной кампипериметрии (ККП), внутриглазного давления (ВГД) методом бесконтактной тонометрии (БТ) и по Маклакову, центральной толщины роговицы (ЦТР) методом контактной кератопахиметрии, толщины слоя нервного волокна (ТСНВ) методом оптической когерентной томографии (ОКТ). В системное обследование входили биохимический анализ крови (коагулограмма, липидограмма), наблюдение кардиолога, невропатолога и терапевта. Комплексное лечение пациентов основной группы включало постоянный прием норваска или амлодипина (5 мг в сутки) по согласованию с кардиологом и глазных капель Бетоптик С. Пациенты контрольной группы не получали препараты из группы БКК. Для компенсации ВГД в обеих группах назначали траватан. Два раза в год пациенты обеих групп получали курс сосудистой терапии (актовегин, милдронат, витамин С, мильгама или нейровитан). Результаты Сравнительный анализ исходного распределения пациентов по возрасту, полу, наличию сопутствующих заболеваний (ГБ), а также результатам определения ОЗ, ВГД, ПЗ, ТСНВ, ТЦР свидетельствовал о количественно-качественной идентичности состава основной и контрольной групп. Контроль ВГД показал, что у пациентов обеих групп было достигнуто снижение ВГД на 20-25% от исходного уровня. Сравнительный анализ динамики изменения исследуемых показателей в течение 3-х лет по результатам цифровых методов исследования свидетельствовал о стойком уровне стабилизации всех исследуемых показателей в основной группе. В контрольной группе было зафиксировано необратимое ухудшение морфофункциональных показателей без снижения центральной остроты зрения. Так, уменьшение ТСНВ на 5-10% (по данным ОКТ) и светочувствительности сетчатки с коэффициентом MD (по данным ККП) на 10-15% отмечено у 7 больных с ПОУГ (30,4% случаев) и у 9 — с НТГ (44,1% случаев). Таким образом, несмотря на строгое соблюдение режима приема медикаментозных препаратов, в контрольной группе у 30,4% пациентов с ПОУГ и у 44,1% с НТГ наблюдалось постепенное ухудшение морфофункциональных показателей, свидетельствовавшее о прогрессировании глаукомной оптической нейропатии. В большей степени это касалось пациентов с глаукомой нормального давления. Стабильность морфофункциональных показателей у пациентов как с ПОУГ, так и с глаукомой нормального давления отмечена у пациентов основной группы. Можно полагать, что назначенный курс терапии с включением препаратов из группы БКК как для системного, так и для местного применения создавал определенный уровень постоянной нейроретинопротекции или защиты ганглиозных и других клеток на уровне зрительного анализатора за счет сохранения физиологического уровня кальциевого гомеостаза, на уровне соматической мембраны ганглиозных и других клеток неврального синапса. Без прямой нейроретинопротекции на системном и локальном уровнях такой уровень защиты обеспечить не удается, о чем свидетельствует отрицательная динамика морфофункциональных показателей в контрольной группе.
Выводы 1. Современные данные о роли ишемии в развитии оптической нейропатии при глаукоме являются обоснованием для применения препаратов прямого нейропротекторного действия в комплексном лечении глаукомы. 2. Блокаторы кальциевых каналов, контролируя вход ионов кальция внутрь ганглиозной клетки и эндотелия сосудов, оказывают выраженный нейроретинопротекторный эффект за счет усиления прямого нейропротекторного эффекта сопутствующим вазоселективным, или непрямым, нейроретинопротекторным действием. 3. Системное и местное применение БКК в комплексном лечении больных глаукомой создает условия для длительной защиты ганглиозных клеток сетчатки на уровне их соматической мембраны от разрушительного действия ишемии, обеспечивая более устойчивое равновесие морфофункционального состояния зрительного анализатора у больных глаукомой.
Литература 1. Анисимова С.Ю. Нейропротективная терапия глаукомы // Биолог. мед. — 2002. — С. 39-42. 2. Анисимов С.И. Результаты консервативного лечения частичной атрофии зрительногшо нерва при глаукоме // Глаукома: Всеросс. научн.-практ. конф.: Материалы. — М., 1999. — С. 332-333. 3. Астахов Ю.С. Нейропротекторное действие препарата ретинолами при лечении первичной открытоугольной глаукомы методом эндоназального электрофореза // РООФ: Сб. научн. труд. — М., 2010. — Т. 1. — С. 232-236. 4. Бунин А.Я. Метаболические факторы патогенеза первичной открытоугольной глаукомы // Глаукома на рубеже тысячелетия: итоги и перспективы: Всеросс. научн.-практ. конф.: Материалы. — 1999. — С. 9-12. 5. Веселовська З.Ф. Новий підхід в медикаментозній терапії первинної відкритокутової глаукоми з низьким тиском на основі застосування блокаторів кальцієвих каналів // Офтальмол. журн. — 2006. — № 3. -Т. 1. — С. 88-89. 6. Веселовская З.Ф. Современные аспекты нейропротекции в лечении хронической сосудистой патологии зрительного анализатора // Проблемы екологичної та медичної генетики і клінічної імунології: Зб. наук. праць. — Луганськ, 2011. — С. 80-86. 7. Веснина Н.А. Комплексное лечение глаукомы // Глаукома: теории, тенденции, технологи: VIII международ. конф.: Сб. научн. стат. — М., 2010. — С. 83-84. 8. Волков В.В. Существенный элемент глаукоматозного процесса, не учитываемый в клинической практике // Офтальмол. журн. — 1976. — № 7. -С. 500-504. 9. Завгородняя Н.Г. Первичная глаукома. Новый вигляд на старую проблему // Запорожье. — 2010. — 184 с. 10. Нестеров А.П. Первичная открытоугольная глаукома: патогенез и принципы лечения // Клин. офтальмология. — 2000. — Т. 1. — № 1. — С. 4-5. 11. Levi A. An introduction to neuroprotection in glaucoma/ mechanism and implication // Europ. J.Ophthalmol. — 1999. — Vol. 9. — P. 7-8. 12. Levin L.A. Neuroprotection for glaucoma // Ethis Communications Inc. — New York, 2007. — 88 p. 13. Rogawski M.A. Low-affinity channel blocking (uncompetitive) NMDA receptor antagonists as therapeutic agents-toward an understanding of their favorable tolerability // Amino Acids. — 2000. — Vol. 19. — P. 133-149. 14. Weinreb R.N. Glaucoma neuroprotection // Wolters Kluwer Health. — Philadelphia, 2006.- 114 p.
Поделиться в соц. сетях
Нравится
Капли от глаукомы
Основной целью лечения глаукомы является снижение внутриглазного давления для предотвращения повреждения и сохранения функций зрительного нерва.
Как правило, лечение глаукомы начинают с назначения капель, снижающих внутриглазное давление. Эти капли необходимо капать постоянно, строго по инструкции врача.
Регулярность их закапывания – это, в определённой степени, гарантия успешности лечения. При неэффективности одних капель в поддержании нормального внутриглазного давления, доктор может вам усилить режим, назначив дополнительно капли другой химической группы, тем более, что одни капли могут усиливать действие других.
Все глазные капли всасываются через поверхностные сосуды в глазной кровоток и, пусть в небольшом количестве, но всё же попадают в системный кровоток. Активно действующие химические вещества некоторых капель от глаукомы имеют побочные нежелательные эффекты на сердечно-сосудистую и дыхательную системы организма, поэтому врачу-офтальмологу очень важно знать ваши общие хронические заболевания.
Если пациент по общему состоянию или каким-то другим причинам не способен регулярно закапывать капли от глаукомы, то лучше ему предложить другие методы лечения.
Виды капель для снижения внутриглазного давления
На сегодняшний день существует много различных препаратов от лечении глаукомы в форме глазных капель, которые классифицируются:
- по активно действующему химическому веществу: простагландины, бета-блокаторы, холиномиметики и др.,
- по механизму снижения внутриглазного давления: уменьшающие продукцию внутриглазной жидкости, улучшающие отток внутриглазной жидкости и препараты комбинированного механизма действия.
Аналоги простагландинов
Простагландины – это высокоэффективные и безопасные препараты от глаукомы. Внутриглазное давление снижается через 2 часа после закапывания, максимальный эффект достигается через 12 часов.
Эти препараты: Траватан (Alcon), Ксалатан (Pfizer), Тафлупрост и др., – появились относительно недавно. Тем не менее, благодаря их высокой эффективности и длительности действия ( их необходимо закапывать всего 1 раз в сутки), они зарекомендовали себя как препарат выбора в лечении глаукомы.
Механизм их действия основан на улучшении оттока внутриглазной жидкости через дополнительный путь оттока.
Но у препаратов группы простагландина имеется ряд побочных эффектов: преходящее покраснение глаз (из-за расширенных поверхностных сосудов), изменение цвета радужки (она становится более тёмной) и усиление роста ресниц (они становятся более густыми, длинными и тёмными).
Последний побочный эффект простагландинов, который радует некоторых пациенток, нашел применение и у косметических компаний.
Бета-блокаторы
Это группа препаратов снижает продукцию внутриглазной жидкости. Они начинают действовать через 30 минут после применения с максимальным эффектом через 2 часа, поэтому кратность их закапывания, как правило, 2 раза в день. Их часто назначают в комбинации с простагландинами для усиления эффекта.
Тимолол, Арутимол, Окумол, Окупресс, Окумед – это неполный перечень существующих бета-блокаторов, применяемых в лечении глаукомы. Как правило, действующее химическое вещество у них одно, поэтому они взаимозаменяемы.
Но у этих препаратов есть ряд побочных эффектов: снижение частоты сердечных сокращений, спазм бронхов и др. Поэтому эти препараты противопоказаны людям с некоторыми заболеваниями сердца, бронхиальной астмой, эмфиземой легких.
Существует высокоселективные бета-блокаторы Бетоптик и Бетоптик С (Alcon), их побочные эффекты на сердечно-сосудистую и дыхательную систему менее выражены, чем у других препаратов этой группы.
Ингибиторы карбоангидразы
Ингибиторы карбоангидразы : Азопт (Alcon) , Трусопт, – снижают продукцию внуриглазной жидкости. Это высокоэффективные и безопасные препараты, которые не имеют побочных эффектов на сердечно-сосудистую и дыхательную систему, но должны с осторожностью применяться у людей с некоторыми заболеваниями почек.
Ингибиторы карбоангидразы назначаются, как правило, 2 раза в день и могут при необходимости назначаться в комбинации с другими каплями, например, бета-блокаторами или простагландинами.
Таблетированный препарат Диакарб имеет то же действующее вещество, что и Азопт, и также может применяться в лечении глаукомы, особенно при острых и подострых приступах глаукомы.
Холиномиметики
Эти препараты ( Пилокарпин, Карбохолин ) улучшают отток внутриглазной жидкости путём сужения зрачка и сокращения определённых групп внутриглазных мышщ, что приводит к облегчению прохождения внутриглазной жидкости через угол передней камеры.
Пилокарпин, как основной представитель этой группы, чаще всего назначается при узкоугольной или закрытоугольной глаукоме с целью приоткрыть дренажную сеть от корня радужки. Назначаются в среднем 1-2 раза в день. При необходимости пилокарпин назначают в комбинации с другими препаратами, например, бета-блокаторами, ингибиторами карбоангидразы, аналогами простагландинов.
Побочные эффекты пилокарпина обусловлены узким зрачком, что может ограничивать поле зрения и вызывать неприятные болевые ощущения в области лба, бровей, виска.
Комбинированные препараты
Разработаны капли, содержащие несколько действующих химических веществ в одном флаконе. При назначении нескольких препаратов одновременно, а это происходит довольно часто, применение комбинированных капель позволяет уменьшить количество пузырьков и иногда уменьшает кратность закапывания.
Такими препаратами являются:
- Ксалаком (Pfizer) = Ксалатан + Тимолол.
- Косопт (Merck) = Трусопт + Тимолол
- Фотил = Пилокарпин + Тимолол
Нейропротекторы в лечении глаукомы
Нейропротекторное лечение, т.е. лечение, направленное на улучшение питания, кровоснабжения зрительного нерва, играет важную роль в прогнозе и течении глаукомы. Исследования, изучающие изменения в зрительном нерве при глаукоме, доказывают целесообразность и необходимость нейропротекторного лечения при любой форме глаукомы, особенно при развитых и далекозашедших стадиях.
Важно отметить, что имеются исследования, доказывающие некоторое нейропротективное действие противоглаукомных капель : аналогов простогландинов,бета-блокаторов и др. Но этого, как правило, бывает недостаточно.
На сегодняшний день известно много препаратов, разного происхождения и химического состава, имеющих определённые нейропротективные свойства. Основные группы нейропротекторов:
- Средства, улучшающие кровообращение: гинко билоба, трентал, дицинон и др.
- Средства, улучшающие регенерацию нервной ткани: пикамелон, циннаризин, ноотропил, фезам и др.
- Средства, активирующие питание нервной ткани: ретиналамин, кортексин, семакс, церебролизин, нобен и др.
- Антиоксиданты и витамины : эмоксипин, мексидол, аевит, рутин, аскорбиновая кислота, витамин Е, витамины группы В, рибоксин, лютеин-комплекс, мертилен форте, гистохром, эрисод и др.
Источник: https://www.vseozrenii.ru/glaznye-bolezni/kapli-ot-glaukomy/
Нейропротекция и нейрорегенерация при глаукоме
Следовательно, офтальмологи могут перенять опыт коллег-неврологов и использовать те препараты, которые применяют они в лечении хронических нейродегенеративных заболеваний. В этом плане заслуживает внимания акатинол мемантин, который, к сожалению, не показал своей эффективности при глаукоме в 3-ю фазу клинических испытаний при многоцентровых исследованиях, в отличие от болезни Альцгеймера, при которой данный препарат был разрешен к применению комитетом FDA в США. Канадские ученые испытывали мемантин на приматах. Они взяли небольшую группу и получили впечатляющие результаты — сохранялись нейроны во всех слоях наружных коленчатых тел и коры головного мозга (слайд 2).
Слайд 2. Применение акатинол мемантина у приматов (экспериментальная модель глаукомы). Заметно сохранение нейронов наружных коленчатых тел на фоне лечения
Первая публикация на эту тему появилась в 2006 г. Еще одно важное наблюдение было предпринято N. Gupta и Y. Yucel уже на пациенте, когда наблюдали женщину 79 лет, которая при жизни болела глаукомой. Ее наблюдали 19 месяцев, это была глаукома нормального давления, и пациентка получала лечение дорзоламидом. Она умерла от вирусного миокардита. На вскрытии было обнаружено существенное уменьшение наружных коленчатых тел и зрительной коры головного мозга, аналогичное тем, что наблюдалось у приматов с экспериментальной глаукомой. Сейчас в Торонто продолжаются исследования на приматах. В 2011—2013 годах ученые стали изучать дендриты и обнаружили, что уменьшение их количества является самым ранним индикатором того, что клетка обращается в состояние апоптоза, поскольку нарушается передача информации между клетками. В публикации 2010 года, посвященной пластичности дендритов в наружных коленчатых телах, было показано, что при экспериментальной глаукоме у приматов ранее всего уменьшается количество дендритов. Следовательно, возникают перспективы лечения глаукомы на ранней стадии. В настоящее время эти исследования продолжаются.
В следующей части доклада проф. Н.И. Курышева остановилась на общих чертах патогенеза глаукомы и болезни Альцгеймера, подчеркнув, что теория протеинового мисфолдинга (т.е. нарушения правильной укладки белковой молекулы) в настоящее время рассматривается как ведущая наряду с теорией окислительного стресса, эксайтотоксического феномена и аутоиммунного воспаления. Закономерный вопрос: как часто бывает глаукома при болезни Альцгеймера. Результаты исследований по этому поводу очень противоречивы. По сути, у каждого четвертого больного болезнью Альцгеймера есть глаукома. При обоих заболеваниях выявлено отложение амилоида бета, активация каспаз, при болезни Альцгеймера увеличена ЭДЗН и имеется истончение нервных волокон сетчатки, а также нарушена транссинаптическая передача. Более того, было установлено, что даже генетические факторы, характерные для болезни Альцгеймера, обнаружены при глаукоме.
Существует ли лечение нейродегенеративной патологии в реальном мире? Ответ, к сожалению, отрицательный. Кроме акатинол мемантина, применяемого при болезни Альцгеймера, положительной информации по этому поводу пока нет.
На сегодня офтальмологам приходится рассчитывать только на то, что препараты для местного гипотензивного лечения имеют прямые нейропротекторные свойства.
Первая публикация на эту тему относится к 1996—1997 гг., когда проф. Осборн продемонстрировал в эксперименте на кроликах и в культуре изолированных ганглиозных клеток нейропротекторное действие бетаксолола. Оказалось, что этот препарат действительно повышал выживаемость ГКС при экспериментальной глаукоме. Было доказано, что он уменьшает поступление кальция в клетку, уменьшает апоптоз нейронов, и очень скоро было проведено исследование, в котором сравнили бетаксолол с тимололом и бримонидином.
О прямых нейропротекторных свойствах бримонидина за последние 10 лет было очень много публикаций, что практически сделало этот препарат номером один в лечении глаукомы.
Указанные свойства бримонидина объясняются его селективным воздействием на альфа-2-рецепторы. Именно их возбуждение приводит к комплексному воздействию на нейроны сетчатки, защищая их от апоптоза.
В 2003 г. Стефано Гандольфи провел очень интересный эксперимент на пациентах в клинике.
В двух группах больных (в одной применяли лазерную трабекулопластику, в другой — лечение бримонидином) сначала определили скорость прогрессирования глаукомы, а потом начали лечить и посмотрели, с какой скоростью будет продолжаться прогрессирование. Обнаружили, что лазерное лечение только замедляло прогрессирование, а бримонидин улучшал поля зрения. Так в клинике было получено доказательство прямого нейропротекторного действия бримонидина. Другое исследование, проведенное в США при глаукоме нормального давления, показало, что при лечении бримонидином прогрессирование было в три раза меньше, чем на тимололе, но, к сожалению, отмечались побочные действия.
Глава в одном из последних журналов «Прогресс в исследовании мозга» называется так: «Глаукома — открытое окно в нейропротекцию, нейрорегенерацию». Это означает, что на примере глаукомы возможен поиск лечения нейродегенеративной патологии. Офтальмологи должны сотрудничать с неврологами, проводить совместные исследования и симпозиумы, потому что опыт может оказаться уникальным.
Следующим докладчиком был профессор Bernhard Sabel, директор Университета нейрофизиологии и психологии Магдебургского университета (Германия). Идея пригласить проф. Sabel была продиктована тем, что в отсутствии эффективных медикаментозных нейропротекторных способов лечения метод, разработанный проф. Sabel, заслуживает внимания. Об этом свидетельствовала реакция офтальмологов на мировом конгрессе в Токио, где все доклады проф. Sabel воспринимались с большим энтузиазмом. В настоящее время проф. Sabel проводит уникальные исследования в клиниках Китая, к нему на лечение направляют своих пациентов такие известные глаукоматологи мира, как R. Ritch и R. Weinreb.
Докладчик начал с того, что подчеркнул важную роль мозга в обеспечении зрительной функции и недостаточное понимание этого аспекта офтальмологами всех стран.
В коре головного мозга, обрабатывающей зрительный сигнал, нейронов больше в 300 раз, чем в сетчатке.
Исследования с помощью МРТ показали, что у пациентов с глаукомой есть изменения в лобной доле коры головного мозга по сравнению с аналогичным отделом мозга здоровых людей такого же возраста. Был сделан вывод о том, что при нарушении зрительных функций поражается не только зрительный анализатор, но и другие области коры головного мозга.
В результате экспериментов на грызунах B. Sabel сделал вывод о том, что при сохранении 10-20% нейронов сетчатки возможно со временем восстановление до 80% зрительных функций, и это обеспечивается работой головного мозга. При глаукоме участки серого цвета, заметные при периметрии, отражают работу нейронов со сниженной зрительной функцией, но еще живых. Это области резидуального (остаточного) зрения.
Сутью восстановления функций указанных нейронов является синхронизация волн в коре головного мозга. Проследить за этим можно с помощью электроэнцефалографии. При использовании специального шлема с датчиками можно увидеть взаимосвязь работы разных центров в мозге и понять, синхронизированы они или нет в своих функциях (слайд 3).
Слайд 3. Электроэнцефалография, позволяющая выявить синхронизирование волн в коре головного мозга и взаимосвязь работы в нем разных центров
Если сравнить пациентов с глаукомой и группу контроля (здоровые лица) и проанализировать волны, идущие в коре головного мозга в обеих группах, то оказывается, что здоровые лица отличаются от больных глаукомой именно характером альфа-2-волн.
Страницы: 2
Нейропротекторы и глаукома
Медикаментозная нейропротекция при глаукоме назначается с целью нормализации и активации метаболических процессов в глазу. Правильно подобранный терапевтический курс позволить снизить частоту и остроту приступов недуга, укрепить глазные нервы и обеспечить необходимое питание тканям роговицы.
Нейропротекторы: что это за лекарства и зачем нужны
Основным источником болезненных симптомов при глаукоме являются чрезмерно повышенное глазное давление и дисфункция нервных волокон глаза. Консервативная медикаментозная нейропротекторная терапия способна скорректировать второй фактор и частично повлиять на первый.
Применение нейропротекторных средств не практикуется как отдельный вид лечения, а идет в комплексе с глазной гимнастикой, занятиями на тренажерах, лазерным и оперативным вмешательством для минимизации негативного воздействия недуга.
С помощью правильно подобранных лекарств можно укрепить нейронные волокна глазных нервов, что положительно скажется на остроте зрения, а также сбалансировать внутриглазное давление, предотвращая его рост за счет оттока избыточной жидкости.
Виды медикаментов
С данной целью больным назначаются и инъекционные формы препаратов.
Для консервативной медикаментозной терапии при глаукоме используют комбинацию фармпрепаратов, которые обеспечивают нейтрализацию негативных симптомов: снимают отечность, выводят избыточную внутриглазную жидкость, стимулируют метаболические процессы и микроциркуляцию крови, укрепляют нейронные волокна и питают клетки роговицы, предотвращая дистрофию.
Согласно публикации в РМЖ «Клиническая Офтальмология» № 2, 2014 г., нейропротекция является одной из наиболее перспективных стратегий лечения глаукомы. Офтальмологи назначают таблетированные медпрепараты и инъекции — внутримышечные, внутривенные и окулярные, а также закапывание и инстилляцию глаз растворами. В комплексную терапию входят:
- спазмолитики;
- ноотропы;
- ангиопротекторы;
- нейропептиды;
- блокаторы кальциевых каналов;
- ферментированные и неферментированные антиоксиданты.
Нейропротекторы не лечат глаукому, а используются для снятия болезненных симптомов.
Бета-блокаторы в лечении глаукомы. Назад в будущее (литературный обзор)
Авторы проводят анализ безопасности и эффективности местных бета-адренергических препаратов для лечения глаукомы. Особое внимание уделено пролонгированным лекарственным формам тимолола малеата. Ключевые слова: глаукома, бета-адреноблокаторы, тимолола малеат, Тимолол гель. Abstract Beta-blockers in treatment of glaucoma. Back to the future. Literature review Egorov E.A., Egorov A.E.
RNRMU named after I.N. Pirogov Authors analyze effectiveness and safety of topical beta-adrenergic drugsfor treatment of glaucoma. Particular attention is paid to prolonged formof timolol maleate. Key words: glaucoma, beta-adrenoblockers, timolol maleate, Timolol gel.
Глаукома относится к хроническим заболеваниям, требующим постоянного лечения. Консервативное лечение глаукомы подразумевает назначение местных гипотензивных препаратов в течение длительного времени для поддержания нормального уровня внутриглазного давления (ВГД). Безопасность и хорошая переносимость гипотензивных лекарственных средств имеют основное значение для соблюдения пациентами рекомендаций врача и режима применения данных препаратов и, как следствие, поддержания зрительных функций больных глаукомой [6, 15, 25]. Выбор препаратов для консервативного лечения больного глаукомой зависит от ее формы и сопутствующих заболеваний. Также нужно учитывать особенности механизма действия, фармакодинамики и состав назначаемых препаратов. Офтальмологические препараты могут вызывать не только местные, но и системные побочные реакции в результате абсорбции в кровяное русло [32]. В последние годы в литературе уделяется огромное внимание такому понятию, как приверженность к лечению [17]. Она непосредственно связана с режимом дозирования и длительностью лечения. Чем чаще в течение дня пациент должен закапывать препарат, тем больше вероятность того, что режим дозирования будет нарушен [18]. Появление в конце 1970-х гг. бета-адреноблокаторов в виде глазных лекарственных форм стало большим шагом вперед в лечении глаукомы. В течение последних лет блокаторы бета-адренергических рецепторов относят к рекомендованным препаратам первого выбора [3, 4]. Основное место среди них занимает тимолола малеат [7]. При лечении местными бета-адреноблокаторами могут наблюдаться как местные, так и системные побочные эффекты. К наиболее частым системным проявлениям относят реакции со стороны дыхательной и сердечно-сосудистой систем (колебания частоты сердечных сокращений и уровня артериального давления). Степень выраженности, а также частота проявления системных побочных эффектов местных бета-блокаторов обусловлены особенностями их фармакокинетики. При местном применении тимолола малеат не подвергается первичному метаболизму в печени, что приводит к его значительной концентрации в плазме крови и повышению риска системных побочных реакций [14, 35]. После инстилляции около 80% количества глазных капель попадает в системный кровоток. Учитывая то, что 0,5% раствор тимолола малеата применяется 2 р./сут, можно предположить, что это количество, соответствующее 200 мкг действующего вещества, будет увеличивать риск развития серьезных побочных реакций [25]. Одним из путей уменьшения частоты и выраженности побочных эффектов бета-блокаторов является назначение их пролонгированных форм, в частности пролонгированной формы тимолола малеата. Это позволяет достичь и поддерживать оптимальную эффективную концентрацию активного вещества на протяжении длительного времени. В России мультицентровое исследование пролонгированной лекарственной формы тимолола малеата было проведено в 1998 г. в 7 офтальмологических центрах с участием 111 больных (161 глаз) с ПОУГ или глазной гипертензией. Пациентам назначался 0,5% раствор пролонгированного тимолола малеата (Тимоптик-депо) 1 р./сут. В случае, если после 4 и 8 нед. монотерапии Тимоптиком-депо уровень истинного ВГД оставался выше 21 мм рт. ст., пациентам назначалась дополнительная терапия. Эффективность монотерапии Тимоптиком-депо оценивалась на основании данных об уровне офтальмотонуса через 4 нед. применения препарата у тех пациентов, монотерапия у которых оказалась неэффективной (50 глаз), и данных измерения ВГД, полученных при осмотре через 8 нед. лечения (111 глаз). Средний уровень ВГД при завершении лечения Тимоптиком-депо составил 18,5±5,5 мм рт. ст. В среднем уровень офтальмотонуса снизился на 7,3±5,1 мм рт. ст. (р<0,01) (рис. 1). Исследование полей зрения показало, что на фоне проводимой терапии в течение 12 нед. уменьшилась частота регистрации абсолютных и относительных скотом. Снизилось также и максимальное число относительных скотом, выявляемых при обследовании одного глаза. На фоне применения Тимоптика-депо в течение 12 нед. не наблюдалось значительного изменения уровня артериального давления. Отмечалось умеренно выраженное изменение частоты сердечных сокращений. За весь период исследования у 6 (5,41%) пациентов была выявлена клинически значимая синусовая брадикардия. Применение Тимоптика-депо 1 р./сут позволяло контролировать уровень офтальмотонуса и уменьшить амплитуду его колебаний в течение суток. Пролонгированная форма тимолола малеата оказывала менее выраженное влияние на частоту сердечных сокращений по сравнению с его водным раствором [11]. Эффективность и безопасность Тимоптика-депо были также изучены в сравнении с эффективностью и безопасностью 0,5% раствора бетаксолола и 0,5% раствора тимолола малеата [1, 2]. В исследование были включены здоровые добровольцы и больные первичной открытоугольной глаукомой (ПОУГ). Всего было обследовано 230 человек (368 глаз). Через 8 нед. лечения Тимоптик-депо демонстрировал наибольшую эффективность в сравнении с 0,5% раствором тимолола и 0,5% раствором бетаксолола. Другой препарат пролонгированного действия – Ниолол гель 0,1%, включающий тимолол в сочетании с карбомером для доставки действующего вещества, был изучен в нескольких исследованиях в сравнении с 0,5% водным раствором тимолола малеата [20, 26, 28, 33]. Местная концентрация обоих препаратов была сравнима (рис. 2). Было отмечено, что через 8 нед. применения препаратов снижение ВГД в обеих группах было сравнимым [26, 28]. Статистически значимым было значение остаточного снижения ВГД по истечении более 24 ч с момента инстилляции Ниолол геля. Таким образом, длительность действия новой формы тимолола превосходила таковую 0,5% водного раствора в 5 раз [20]. Было также проведено 4-недельное сравнительное исследование у 32 пациентов (64 глаза) с ПОУГ фиксированной комбинации аналогов простагландина и водного раствора 0,5% тимолола малеата (латанопрост+тимолол, травопрост+тимолол, биматопрост+тимолол) с нефиксированной комбинацией аналогов простагландина: латанопроста, травопроста и биматопроста и 0,1% тимолола в гелевой форме. Во всех группах снижение уровня ВГД было более выражено и статистически значимо (p<0,001) при назначении нефиксированной комбинации с пролонгированной формой тимолола малеата. Назначение 0,1% тимолола в гелевой форме также позволило увеличить число пациентов с суточными колебаниями ВГД ≤ 2 мм рт. ст. [12]. Относительно частоты и выраженности системных побочных эффектов сравнительные исследования 0,5% раствора тимолола и 0,1% тимолола в виде гидрогеля показали, что уровень артериального давления, частота сердечных сокращений, изменения интервала QT и PR менее подвержены изменениям при назначении пролонгированной формы тимолола [1, 2, 12, 16, 20, 21, 26, 28]. Наряду с этим некоторые исследователи сообщают о сравнимой безопасности в отношении двух лекарственных форм тимолола [22]. Благодаря медленной абсорбции тимолола из данной лекарственной формы он определяется в плазме крови в меньших концентрациях, чем обычный раствор тимолола малеата [5]. В ряде исследований было показано, что гипотензивный эффект при однократном применении 0,1% пролонгированной формы сравним с эффектом при двукратном назначении 0,5% концентрации обычного раствора тимолола малеата или превосходит его [12, 20]. При этом гелевая форма тимолола малеата оказывает менее выраженное влияние на частоту сердечных сокращений по сравнению с его водным раствором [1, 2, 5, 12, 13, 16, 19–21, 23, 26, 28, 34] (рис. 2). Таким образом, при аналогичной эффективности применение пролонгированной формы тимолола малеата связано с меньшим числом побочных эффектов системного характера. Это также способствует снижению стоимости лечения [26]. Недавно появившийся на рынке новый препарат тимолола малеата в виде глазного геля Офтан® Тимогель содержит в своем составе вспомогательные вещества: карбомер, сорбитол и поливиниловый спирт. Они позволили уменьшить концентрацию активного компонента (тимолола малеата) без ущерба для его эффективности и увеличить продолжительность местного гипотензивного действия. Как следствие, улучшилась местная и системная переносимость препарата. На этапе разработки препарата и в постмаркетинговый период было проведено несколько рандомизированных контролируемых, а также открытых наблюдательных клинических исследований при общем участии около 1200 пациентов [24, 26, 30]. Согласно полученным результатам, Офтан® Тимогель при закапывании 1 р./сут не уступал по эффективности глазным каплям 0,5% тимолола малеата в стандартной дозировке 2 р./сут (рис. 4). Также было отмечено, что уменьшение концентрации активного компонента в препарате приводит к 5–10-кратному снижению концентрации тимолола в плазме крови по сравнению со стандартным режимом применения глазных капель 0,5% тимолола или комбинированных глазных капель латанопроста и тимолола [24, 29, 30]. Снижение концентрации тимолола в плазме крови напрямую коррелировало с более низкой частотой системных побочных эффектов. В частности, было установлено, что Офтан® Тимогель оказывает значимо меньшее влияние на частоту сердечных сокращений, чем глазные капли 0,5% тимолола. Оценивалась динамика частоты сердечных сокращений при ортостатической пробе [29, 30]. В норме частота сердечных сокращений после перехода из горизонтального положения в вертикальное увеличивается, а после перехода из вертикального положения в горизонтальное – уменьшается. Эта зависимость сохранялась при проведении ортостатической пробы на фоне применения глазного геля Офтан® Тимогель, в то время как на фоне инстилляций глазных капель 0,5% тимолола наблюдалась статистически значимая депрессия частоты сердечных сокращений по сравнению с исходными данными (рис. 5). Как известно, в большинстве случаев для гипотензивных глазных капель в качестве консерванта используется бензалкония хлорид в различных концентрациях. Токсическое действие бензалкония хлорида зависит от его концентрации и времени экспозиции и в наибольшей степени проявляется при продолжительном лечении, каковым и является лечение глаукомы. Бензалкония хлорид в составе глазных капель при длительном применении оказывает повреждающее действие на липидный слой слезной пленки, уменьшает слезопродукцию, а также нарушает структуру эпителия роговицы, способствует апоптозу бокаловидных клеток конъюнктивы и увеличению риска хронических воспалительных заболеваний глаза. Учитывая вышесказанное, пациентам с глаукомой рекомендуется назначение препаратов с минимальной возможной концентрацией консерванта или без него. Количество консерванта в Офтан® Тимогеле составляет 0,05 мг на 1 г препарата, то есть снижено вдвое по сравнению с 0,5% раствором тимолола малеата. Это обусловливает лучшую местную переносимость гелевой формы тимолола по сравнению с глазными каплями. При переводе пациентов с глазных капель 0,5% тимолола на Офтан® Тимогель достоверно сокращались жалобы на зуд, слезотечение, жжение и чувство инородного тела в глазу [26]. При назначении пациентам, ранее получавшим лечение Офтан® Тимогелем, глазных капель 0,05% тимолола малеата отмечалась большая выраженность местных побочных реакций (рис. 6). Назначение бета-блокаторов в качестве препаратов первого выбора оправданно с экономической и терапевтической точки зрения. Однако следует учитывать риск возникновения системных побочных эффектов, что может упускаться врачом из виду при назначении местных препаратов. Особое внимание требуется при лечении пожилых пациентов в связи с наличием у них сопутствующих хронических заболеваний сердечно-сосудистой и дыхательной системы. Применение пролонгированных форм тимолола малеата у пациентов с ПОУГ и глазной гипертензией приводит к выраженному снижению уровня ВГД, которое сравнимо или даже превосходит таковое при терапии 0,5% водным раствором тимолола малеата, а также к менее значимым колебаниям ВГД в течение суток. Благодаря низкой концентрации в плазме крови удается уменьшить и частоту, и интенсивность побочных реакций со стороны органов дыхания и сосудистой системы. Однократное применение в течение дня пролонгированных лекарственных форм тимолола, таких как Офтан® Тимогель, способствует увеличению приверженности пациентов к лечению, а значит, и его эффективности. Также следует отметить снижение затрат на лечение вследствие измененного режима дозирования и уменьшения расходования препарата. Все вышеперечисленное позволяет отнести пролонгированную лекарственную форму тимолола малеата Офтан® Тимогель к эффективным и безопасным средствам лечения глаукомы, обладающим значительными преимуществами перед существующими формами тимолола малеата 0,25 и 0,5%.
Литература 1. Егоров Е.А., Хлобыстов А.А., Ставицкая Т.В., Бродская М.В., Бишеле Н.А. Сравнительное изучение эффективности и безопасности бетаксолола, тимолола малеата и тимоптика-депо: Материалы 11-й научно-практ. конф. «Новые технологии микрохирургии глаза», 14–16 сентября 2000 г., Оренбург. С. 74–77. 2. Егоров Е.А., Ставицкая Т.В., Хлобыстов А.А. Сравнительное изучение влияния бетаксолола, тимолола малеата и тимоптика-депо на офтальмотонус, гемодинамику глаза и проводимость миокарда: Материалы VII съезда офтальмологов России, 16–20 мая 2000 г., Москва. Ч. 1. С. 122. 3. Егоров Е. А. и соавт. Офтальмофармакология. М.: ГЭОТАР-Мед, 2004. 4. Еричев В.П. Основные направления гипотензивного лечения больных первичной глаукомой // Рус. офтальмол. журн. 2000. Т. 1. № 1. С. 18–21. 5. Еричев В.П., Якубова Л. В. Эффективность и безопасность использования тимоптик-депо в гипотензивной терапии глаукомы // Вестник офтальмологии. 1998. Т. 114. № 1. С. 8–9. 6. Куроедов А.В. Перспективы применения комбинированных антиглаукомных препаратов (обзор литературы) // Клиническая офтальмология. 2007. Т. 8. № 4. С. 176–180. 7. Нестеров А.П. Актуальные проблемы терапии глаукомы: Материалы симпозиума «Применение фотила и фотила форте в свете современных принципов лечения глаукомы». М.,1996. C. 3–4. 8. Нестеров А.П. Глаукома. М.: Медицина, 1995. 9. Нестеров А.П. Общая оценка и выбор методов лечения глаукомы;: Сб. науч. тр. «Физиология и патология внутриглазного давления». М., 1987. С. 60–68. 10. Нестеров А.П. Первичная глаукома. М.: Медицина, 1973. 11. Нестеров А.П., Егоров Е.А., Астахов Ю.С., Волков В.В. и др. Тимоптик-Депо: многоцентровое исследование эффективности и безопасности // Medical Market. 1999. Vol. 2. № 32. P. 39–41. 12. Nucci C., Varesi C., Martucci A., Cesareo M., Cedrone C., Mancino R., Cerulli L. Efficacy of timolol 0.1% gel and a prostaglandin analog in an unfixed combination compared to the corresponding fixed combinations // Eur J Ophthalmol. 2013. Vol. 5. Р. 683–689. 13. Dickstein K., Aarsland T. Comparison of the effects of aqueous and gellan ophthalmic timolol оп peak exercise performance in middle-aged men // Am-J-Ophthalmol. 1996 Apr. Vol. 121 (4). Р. 367–371. 14. Edeki T.I., He H., Wood A.J. Pharmacogenetic explanation for excessive beta-blockade following timolol eye drops. Potential for oralophthalmic drug interaction // J. Am. Med assoc. 1995. Vol. 274. Р. 1611–1613. 15. European Glaucoma Society – Terminology & Guidelines for Glaucoma (European Guidelines). Glaucoma Society. 2nd ed. Savona Italy: Editrice DOGMA, 2003. Vol. 3. Р. 3–26. 16. Uusitalo H., Ka..ho..nen M., Ropo A., Ma..enpa..a.. J., Bja..rnhall G., Hedenstro..m H., Turjanmaa V. Improved systemic safety and risk–benefit ratio of topical 0.1% timolol hydrogel compared with 0.5% timolol aqueous solution in the treatment of glaucoma // Graefe’s Arch Clin Exp Ophthalmol. 17. Hitchings R. Impotance of Compliance in the management of glaucoma //Abstract book. Symposium “Glaucoma”, Rome, Italy, 1999. January 29-31. P. 20. 18. Hosoda M., Yamabayashi S., Furuta M., Tsukahara S. Do glaucoma patients use eye drops correctly? // J. of Glaucoma, June 1995. Vol. 4. No. 3. P. 202–206. 19. Kanellopoulos A.J., Perry H.D., Donnenfeld E.D. Comparison of topical timolol gel to oral acetazolamide in the prophylaxis of viscoelastic-induced ocular // Cornea. 1997 Jan. Vol.16 (1). Р. 12–15. 20. Mayer H., von der Ohe N. Efficacy of a novel hydrogel formulation in human volunteers // Ophthalmologica. 1996. Vol. 210 (2). Р. 101–103. 21. Nino J. et al. Cardiovascular effects of ophthalmic 0.5% timolol aqueous solution and 0.1% timolol hydrogel // Clin Physiol Funct Imaging. 2002 Jul. Vol. 22 (4). Р. 271–278. 22. Quaranta L. et al. Circadian intraocular pressure and blood pressure reduction with timolol 0.5% solution and timogel 0.1% in patients with primary open-angle glaucoma // J Clin Pharmacol. 2012 Oct. Vol. 52 (10). Р. 1552–1557. 23. Rosenlund E.F. The intraocular pressure lowering effect of timolol in gel-forming solution // Acta-Ophthalmol-Scand. 1996 Apr. Vol. 74 (2). Р. 160–162. 24. Rouland J.-F. et al. Timolol 0.1% gel once daily versus conventional timolol 0.5% solution twice daily: A comparison of efficacy and safety // Ophthalmologica. 2002. Vol. 216. Р. 449–454. 25. Schwartz G.F. Compliance and persistency in glaucoma follow-up treatment // Curr.Opin Ophthalmol. 2005. Vol. 16. Р. 114–121. 26. Stankiewicz A. et al. A multicenter, observative, non-invasive study of the tolerance of Nyolol gel 0,1% in ocular hypertensive patients // Klinika Oczna. 2004. Vol. 106. Р. 644–647. 27. Stewart W.C., Sine C., Cate E., Minno G.E., Hunt H.H. Daily cost of beta-adrenergic blocker therapy // Arch Ophthlmol. 1997, Jul. Vol. 115 (7). Р. 853–856. 28. Uusitalo H. et al. Evaluation of efficacy and systemic side effects of topical 0.1% timolol gel and 0.5% aqueous timolol maleate // SOE Abstract. 1999. P 353. 29. Uusitalo H. et al. Efficacy and systemic side-effects of topical 0.5% timolol aqueous solution and 0.1% timolol hydrogel // Acta Ophthalmol Scand. 2005. Vol. 83. Р. 723–728. 30. Uusitalo H. et al. Improved systemic safety and risk-benefit ratio of topical 0.1% timolol hydrogel compared with 0.5% timolol aqueous solution in the treatment of glaucoma // Graefe’s Arch Clin Exp Ophthalmol. 2006. Vol. 244. Р. 1491–1496. 31. Uusitalo R. Comparative study on the effect of two timolol preparation in glaucoma // VOX Glaucoma.1995. Vol. 17. No.1. P. 33–35. 32. Valuck J.R., Perlman J.I., Anderson C., Wortman G.I. Co-prescribing of medications used to treat obstructive lung disease, congestive heart failure and depression among users of topical beta blockers: estimates from three US Veterans Affairs Medical Centers // Pharmacoepidemiology and drug safety. 2001. Vol. 10. Р. 511–516. 33. Von der Ohe N., Stark M., Mayer H., Brewitt H. How can the bioavailability of timolol be enhanced? A pharmacokinetic pilot study of novel hydrogels // Graefes Arch Clin Exp Ophthalmol. 1996 Jul. Vol. 234 (7). Р. 452–456. 34. Yamamoto T., Kitazawa Y., Azuma I., Tsukahara S., Nakashima M. Clinical evaluation of a new formula of timolol maleate (WP-934 ophthalmic solution) // Jpn-J-Ophthalmol. 1997 Jul-Aug. Vol. 41 (4). Р. 244–250. 35. Yarangumeli A., Kural G. // Expert Opin. Pharmacother. 2004 May. Vol. 5 (5). Р. 1071–1081.
Лечение Глаукомы
Глаукома – специфическая оптическая нейропатия, характеризующаяся повышением внутриглазного давления (ВГД) вследствие нарушения продукции или оттока из глаза водянистой влаги (внутриглазной жидкости), изменениями полей зрения, экскавацией диска и атрофией зрительного нерва, снижением светочувствительности сетчатки и развитием прогрессирующей оптической нейропатии.
Физиологический средний уровень ВГД составляет 15±1 мм рт. столба и регулируется в основном за счет сопротивления сети трабекул оттоку водянистой влаги из передней камеры глаза в шлеммов канал.
Физиологический уровень ВГД поддерживается за счет равенства двух составляющих: объем притока жидкости, образованной ресничными отростками и объема оттока влаги в шлеммов канал (среднее значение 2.0-2,5 мм3 /мин).
При изменении любой из этих составляющих (скорости продукции влаги либо скорости оттока) неизбежно возникает изменение градиента ВГД, лежащее в основе патофизиологии глаукомы.
Первичная открытоугольная глаукома – патогенез
Причины трабекулопатии и последующей блокады склерального синуса до конца неясны , однако известно, что в патогенезе открытоугольной глаукомы важную роль играют инволюционные изменения соединительнотканных структур склеры и цилиарной мышцы.
Они проявляются нарушением соотношения коллагенового и эластинового компонентов, приводящим к повышению плотности и снижению эластичности соединительной ткани, механическому смещению цилиарной мышцы в сторону передней камеры, и как следствие – нарушению оттока по увеосклеральному пути.
Утолщение трабекулярных пластин, деструкция мышечных волокон, сужение межтрабекулярных щелей в целом уменьшает проницаемость трабекулярного аппарата и соответственно приводит к стойкому нарушению физиологического равновесия между притоком жидкости в переднюю камеру и объему ее оттока через шлеммов канал. ВГД в результате может повышаться до 100 и более процентов от нормального физиологического уровня.
Постоянные нарушения гидродинамики, повышение разности давления в передней камере и шлеммовом канале приводит к блокаде склерального синуса и его сужению, что в свою очередь, приводит к компрессии трабекулярного апарата и хронизации уже имеющихся патологических изменений трабекул, а также сжатию волокон зрительного нерва в месте их выхода из глазного яблока.
Хроническое нарушение гемодинамики способствует снижению перфузии сетчатки глаза и повышению чувствительности зрительного нерва к колебаниям офтальмотонуса.
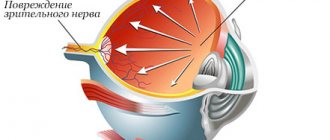
Постоянная же ишемия головки и волокон зрительного нерва вместе с компрессией артерии сетчатки в области зрительного диска приводит к прогрессирующей оптической нейропатии в результате гибели нейронов и атрофии ганглиозных клеток сетчатки.
Первичная закрытоугольная глаукома – патогенез
Первичная закрытоугольная глаукома характеризуется частичным или полным закрытием угла передней камеры глаза корнем радужной оболочки.
Блокада угла передней камеры происходит вследствие закрытия его утолщенной прикорневой складкой радужки при расширении зрачка, которое приводит к еще большему выпячиванию корня радужки, вплоть до постепенного полного закрытия угла передней камеры и сращения корня радужки с его передней стенкой.
К развитию этой формы глаукомы предрасполагают определенные анатомические особенности – мелкая передняя камера с узким углом, крупный хрусталик, утолщенный корень радужки.
Вследствие уменьшения или полного закрытия угла передней камеры на пути оттока водянистой влаги возникает механическое препятствие и нарушается дренажная функция – корень радужной оболочки “прижимается” к дренажной сети, все более закрывая радужно-роговичный угол с последующим образованием спаек.
Из-за спаек еще более затрудняется доступ влаги к дренажной сети, как следствие, в пораженном глазу повышается ВГД. Изменение градиента ВГД далее запускает тот же патологический каскад реакций, что и при открытоугольной глаукоме, с компрессией и ишемией волокон зрительного нерва и артерии сетчатки, что в условиях повышенной чувствительности нерва к колебаниям офтальмотонуса приводит к выраженной экскавации диска, атрофии ганглиев и развитию прогрессирующей оптической нейропатии.
Глаукома – гипотензивная терапия
Первичной целью лечения глаукомы является стабилизация ВГД в целях снижения риска поражения зрительного нерва и развития оптической нейропатии. Для достижения «давления цели» в настоящее время используются две группы препаратов:
Группа 1 – препараты, уменьшающие продукцию водянистой влаги
- селективные и неселективные бета –блокаторы – угнетают продукцию водянистой влаги за счет нейтрализации эффекта катехоламинов в бета-рецепторах, способствуя, таким образом, снижению ВГД;
- ингибиторы карбоангидразы – снижают продукцию водянистой влаги, незначительно улучшают кровоснабжение сетчатки и зрительного нерва;
- агонисты центральных альфа-2 адренорецепторов – улучшают функции дренажной системы и уменьшают выработку водянистой влаги.
Группа 2 – препараты, увеличивающие отток водянистой влаги
- простагландины и аналоги простагландина F2- альфа – усиливают отток водянистой влаги как по основному, так и по увеосклеральному пути за счет взаимодействия со специфическими рецепторами глазного яблока, разрушения коллагеновых фибрилл экстрацеллюлярного матрикса, снижения толщины цилиарной мышцы и сопротивления оттоку водянистой влаги.
Группа 3 – фиксированные комбинации с сочетанным воздействием
- комбинации простагландинов и бета-блокаторов, применяющиеся при неэффективности монотерапии гипотензивными средствами, обеспечивающие как уменьшение продукции водянистой влаги за счет воздействия на бета-рецепторы, так и увеличение ее оттока по увеосклеральному пути за счет описанных механизмов взаимодействия с FP-рецепторами глазного яблока.
Глаукомная оптическая нейропатия
Глаукомная оптическая нейропатия возникает в ответ на снижение толерантности зрительного нерва к повышению ВГД, характеризуясь прогрессирующим поражением и апоптозом волокон зрительного нерва в результате хронической ишемии и комплекса метаболических нарушений.
Хотя точные механизмы глаукомной атрофии волокон зрительного нерва остаются до конца неясными, предполагается, что процесс начинается с нервных волокон, расположенных вокруг центральной ямки, подверженных постоянной ишемии как вследствие нарушения гидродинамики, так и постоянной компрессии главной артерии сетчатки в области центральной ямки. По мере прогрессирования заболевания, усиления ишемии и стойкого нарушения гидродинамического равновесия происходит смещение назад решетчатой пластинки склеры, которая еще более сдавливает нервные волокна, способствуя постепенному увеличению экскавации зрительного диска и сужению неврального кольца, а также распространению процесса на периферические отделы. Сопутствующие нарушения кровоснабжения, микрососудистые нарушения, изменения реологии и снижение перфузии сетчатки ускоряют процесс апоптоза ганглиев сетчатки и диска зрительного нерва, приводя в конечном счете к полной его атрофии и слепоте пациента.
Глаукома – нейропротекция
В целях предотвращения прогрессирования оптической нейропатии второй главной целью терапии глаукомы является нейропротекция, определяемая как прерывание самых ранних процессов, лежащих в основе ишемического каскада реакций и апоптоза нервных волокон.
Тремя основными путями реализации нейропротекции являются ингибиция повреждающего фактора, повышение резистентности зрительного нерва к колебаниям офтальмотонуса и профилактика атрофии зрительного нерва и сетчатки. Нейропротекторная терапия при глаукоме направлена прежде всего на коррекцию метаболических нарушений, возникающих при глаукоме в головке зрительного нерва.
Кроме того, целью лечения является улучшение местной микроциркуляции и трофики тканей, нормализация реологических свойств крови, увеличение основного и коллатерального кровообращения.
Однако нейропротекторная терапия эффективна только при условии достижения “давления цели” с помощью медикаментозного лечения, лазерного или хирургического воздействий (Российское национальное руководство по глаукоме (2011). Поэтому на фоне гипотензивной терапии всем пациентам рекомендуется назначение нейропротекторов.
Нейропротекторы – препараты, которые защищают нейроны сетчатки и волокна зрительного нерва, блокируя различными путями механизмы апоптоза, повышают резистентность нервных клеток и нейтрализуют различные факторы, увеличивающие риск их повреждения. Нейропротекторы делятся на группы первичного и вторичного действия.
Группа 1 – Препараты первичного действия, направленные на прерывание процессов ишемического каскада на ранней стадии
- производные ГАМК – повышают устойчивость к гипоксии нервной ткани за счет ноотропного и сосудорасширяющего действия;
- антагонисты потенциал-зависимых кальциевых каналов – действуют на уровне неврального синапса, блокируя кальциевые каналы пресинаптической мембраны, препятствуя избыточному выбросу нейромедиатора глютамата в синаптическую щель и таким образом связывая хемоуправляемые глютаматом ионные каналы постсинаптической мембраны, препятствуя поступлению ионов Са++ внутрь аксонов и обеспечивая прямую нейропротекцию.
Группа 2 – Препараты вторичного действия, направленные на прерывание отсроченных механизмов гибели нейронов
- антиоксиданты – вызывая разрушение активных форм кислорода, тормозят развитие процессов деградации в трабекулярном аппарате и в волокнах зрительного нерва, а также нейтрализуют свободные радикалы;
- ингибиторы NO-синтазы – блокируют выделение избыточной NO-синтазы, которая выделяется в избыточном количестве астроцитами, приводя к апоптозу ганглионарных клеток сетчатки;
- нейротрофические факторы и регуляторы рецепторных структур – регулируют деятельность нервной ткани за счет выброса специфических эндогенных пептидов;
- аналоги простагландина F2- альфа и их фиксированные комбинации с бета-блокаторами – механизм нейропротекторного действия, как предполагается, обусловлен ингибицией ксантиноксидазы, подавлением активности циклооксигеназы (COX-2) , стимуляцией выработки эндогенных простагландинов PGE2, защищающих нейроны от поражения и активацией F2альфа рецепторов (FP) посредством выработки протеинкиназы.
Источник: https://medstrana.com/articles/5538/
Открытоугольная глаукома: современные подходы к лекарственной терапии
Сегодня собирательный термин «глаукома» объединяет большую группу заболеваний, характеризующихся постоянным или периодическим повышением внутриглазного давления, с последующим развитием типичных дефектов зрения и атрофией зрительного нерва. Эти различные по этиологии болезни имеют ряд общих особенностей в патогенезе, клинике и методах лечения.
Характерная для глаукомы триада признаков:
- периодическое или постоянное повышение уровня внутриглазного давления (ВГД) за пределы уровня, толерантного для зрительного нерва;
- развитие глаукоматозной оптической нейропатии (ГОН) с последующей атрофией (с экскавацией) головки зрительного нерва (ГЗН);
- возникновение характерных изменений поля зрения (ПЗ).
Глаукома – одна из наиболее тяжелых форм офтальмопатологии. Велика и ее социально-медицинская значимость: высокий удельный вес среди болезней органа зрения (в России: миопия – 19,1%; катаракта – 16,4%; глаукома – 7%1); высокая вероятность развития слепоты (в структуре слепоты и слабовидения ее доля составляет 29,0%,2 уступая лишь катаракте) и, как следствие, инвалидности больных; высокие затраты государственных средств на их медицинскую, социальную и бытовую реабилитацию. И конечно же существенный рост заболеваемости.
По прогнозам авторитетного эксперта Quigley H., число больных глаукомой в мире к 2010 г. должно было составить 66,5 млн человек, к 2020 г. – увеличиться до 79,6 млн,2 а к 2030 -му, уже по расчетам Goldberg J., достигнуть 120 млн человек.3 Но уже в 2003 г. на хорошо известном офтальмологам Базельском (Швейцария) международном конгрессе «Лечение глаукомы: современные аспекты и различные мнения» в докладах специалистов прозвучали совсем иные цифры: 105 млн больных глаукомой в мире, слепых на оба глаза – 9,1 млн человек.
По данным профессора Е.С. Либман, в нашей стране в 1965–1995 гг. частота слепоты от глаукомы устойчиво держалась на уровне 14–15% от общего числа слепых.4 За 10 лет (1998–2008) в нозологической структуре слепоты и слабовидения доля глаукомы в России увеличилась более чем в 2 раза – с 14 до 29 %,5 выйдя в бесспорные лидеры.
Российская медицинская статистика по офтальмологическим заболеваниям продолжает красноречиво констатировать неуклонный и стабильный рост распространенности глаукомы (причем не только за счет совершенствования нашей диагностики и мониторинга). По данным главного офтальмолога страны В.В. Нероева, число больных глаукомой по итогам 2011 г. в 82 регионах Российской Федерации – 955 234 человека (на 44 658 человек больше, чем в 2010 г.), распространенность глаукомы в среднем по стране составила 83 на 10 тыс. взрослого населения.6 В 2014 г. эти показатели – 955,2 на 100 тыс. населения (1,1 млн случаев).1
К этому следует добавить, что общая заболеваемость напрямую связана с возрастом: глаукома встречается у 0,1% больных в возрасте 40–49 лет, 2,8% – 60–69 лет, 14,3% – старше 80 лет.7 И что среди многочисленных форм этой офтальмопатологии наибольшее значение имеет первичная открытоугольная глаукома (ПОУГ), составляющая около 70% в структуре всех глаукомных поражений глаз8 и характеризующаяся, как известно, прогрессирующей оптической нейропатией со специфическими изменениями диска зрительного нерва и поля зрения на фоне неустойчивости и повышения уровня офтальмотонуса.
К вопросам патофизиологии
Более 60 лет назад наш знаменитый коллега академик М.И. Авербах охарактеризовал ситуацию с глаукомой просто и понятно: «Проблема глаукомы представляет сплошной хаос, в котором трудно разобраться». И сегодня эти слова во многом актуальны. А сложный патогенез этого заболевания не до конца понятен. Специалисты считают, что ее патофизиология включает генетические и биомеханические факторы, гемодинамические расстройства, изменение внутричерепного давления (градиент давления), изменение дренажной системы, биохимические нарушения и пр.
Аргументированную схему патогенеза первичной глаукомы еще в прошлом веке предложил академик А.П. Нестеров, став одним из основателей нового направления в офтальмологии – гидростатика и гидродинамика глаза. Основными звеньями патогенеза первичной глаукомы он назвал: наследственность; изменения общего характера (нарушения гемодинамики, обмена веществ, нейроэндокринные расстройства); местные дистрофические изменения; нарушения гидродинамики глаза (увеличение сопротивления оттоку внутриглазной жидкости и повышение офтальмотонуса); вторичные сосудистые и дистрофические изменения в тканях глаза и зрительном нерве. Совокупность всех этих факторов приводит к задержке камерной влаги и к повышению ВГД. Циркуляция влаги затрудняется, возникает ее застой, что приводит к ухудшению питания бессосудистых структур глаза. На фоне повышенного ВГД и возникающих нарушений кровообращения в системе, питающей зрительный нерв, развивается глаукомная оптическая нейропатия (ГОН). Апоптозу ганглиозных клеток сетчатки способствуют различные факторы: сдавление аксонов зрительного нерва в отверстиях решетчатой пластинки (смещенной кзади из-за ВГД), нарушение кровоснабжения головки зрительного нерва, образование избытка свободных радикалов из-за ишемии и усиление перекисного окисления липидов (ПОЛ). С ишемией в нервной ткани связано торможение белкового синтеза и активация анаэробного гликолиза, нарушение работы К-Na помпы и деполяризация мембран клеток. Как ответ – выброс глутамата, активизирующего нейроны через NMDA-рецепторы, и поступление избыточного количества ионов кальция в клетку. Чрезмерно высокая концентрация Ca2+ в клетках запускает активацию сложных каскадов нуклеаз, протеаз и липаз, воздействующих на внутриклеточные белки и липиды. Как результат – образование активных свободных радикалов и чрезмерного количества оксида азота (NO), который может способствовать развитию ГОН. А также активных форм кислорода, которые оказывают цитотоксическое действие на сетчатку, зрительный нерв, приводят к деструктивным изменениям в дренажной системе. Таким образом, посредством метаболических процессов свои эффекты реализуют и механические, и сосудистые факторы.9-13
Этапы патогенеза:
Ухудшение оттока внутриглазной жидкости из глазного яблока → повышение ВГД → ухудшение кровоснабжения в структурах глаза → появление зоны ишемии и гипоксии в местах ухудшенного кровоснабжения, что отражается на зрительном нерве → дальнейшее повышение ВГД, ишемия, гипоксия ведут к апоптозу ганглиозных клеток сетчатки и слепоте.
Общие принципы медикаментозной терапии
Несмотря на все это многообразие патогенетических факторов, важное и первоочередное условие успешного лечения глаукомы, в том числе ПОУГ, – нормализация офтальмотонуса и длительная стабилизация его на уровне целевого давления, а на фоне нормализованного ВГД проводится коррекция метаболических и гемодинамических расстройств, способствующих развитию и прогрессированию глаукомной оптической нейропатии.
Таблица 1. Классификационная схема уровня ВГД при глаукоме14
| Уровень ВГД | ВГД тонометрическое , Pt | ВГД истинное, Р0 |
| Нормальное (А) | ≤ 25 мм рт. ст. | ≤ 21 мм рт. ст. |
| Умеренно повышенное (В) | 26≤ Pt ≤32 мм рт. ст. | от 22 ≤ Р0≤ 28 мм рт. ст. |
| Высокое (С) | ≥ 33 мм рт. ст. | ≥ 29 мм рт. ст. |
Сегодня внутриглазное давление (ВГД) может быть снижено медикаментозным, лазерным и хирургическим путем. Чаще всего лечение начинают с местного применения гипотензивных лекарственных препаратов.
В Федеральных клинических рекомендациях «Глаукома первичная открытоугольная»14 экспертами предлагается такой алгоритм действий врача по нормализации ВГД у пациента:
Пациент с подтвержденным диагнозом ПОУГ → монотерапия гипотензивным препаратом → при достижении целевого ВГД → диспансерное наблюдение.
Или:Пациент с подтвержденным диагнозом ПОУГ → монотерапия гипотензивным препаратом → целевое ВГД не достигнуто или плохая переносимость ЛС → смена препарата или лазерное лечение → целевое ВГД не достигнуто → добавление 2-го препарата или назначение фиксированной комбинации → целевое ВГД не достигнуто или плохая переносимость ЛС → другое медикаментозное или лазерное лечение → целевое ВГД не достигнуто или плохая переносимость ЛС → хирургическое лечение, дополнительная гипотензивная терапия.
Таблица 2. Основные фармакологические группы гипотензивных препаратов и механизм их действия
| Фармакологическая группа | Механизм действия |
| Простагландины | улучшающие отток внутриглазной жидкости |
| М-холиномиметики | улучшающие отток внутриглазной жидкости |
| Неселективные β-адреноблокаторы | снижающие продукцию внутриглазной жидкости |
| Селективные β-адреноблокаторы | снижающие продукцию внутриглазной жидкости |
| α- и β-адреноблокаторы | снижающие продукцию внутриглазной жидкости |
| Ингибиторы карбоангидразы | снижающие продукцию внутриглазной жидкости |
| снижающие продукцию внутриглазной жидкости | |
| снижающие продукцию внутриглазной жидкости | |
| α2-селективный адреномиметик | улучшающие отток и снижающие продукцию внутриглазной жидкости |
При выборе лекарственного средства важно следовать общим принципам гипотензивной терапии: еще до начала лечения определяется целевое давление (с учетом всех факторов риска, имеющихся у конкретного больного, и исходных значений ВГД); производится оценка влияния назначенного гипотензивного режима на каждый глаз пациента по отдельности; лечение начинается с монотерапии ЛС первого выбора (при его неэффективности или плохой переносимости – замена на ЛС из другой фармакологической группы или на комбинированный препарат); адекватность достигнутого гипотензивного эффекта регулярно проверяется исследованием состояния ДЗН и зрительных функций. При проведении комбинированной терапии не следует использовать более двух ЛС (тем более одной фармакологической группы) одновременно; предпочтительно применение ЛС в виде фиксированных комбинаций.
При оценке лекарственного воздействия необходимо учитывать:
- тип влияния на гидродинамику глаза;
- степень возможного понижения уровня ВГД;
- наличие противопоказаний к применению;
- переносимость;
- необходимую частоту применения.
А помня, что это лечение многолетнее, на протяжении всей жизни больного, врачу следует не забывать о тахифилаксии и для исключения ее развития проводить плановую замену ЛС.
Применение местных гипотензивных препаратов возможно не только в комбинации друг с другом, но и в сочетании с лазерными и хирургическими методами лечения.
Затем, на фоне нормализованного ВГД, назначается коррекция метаболических и гемодинамических расстройств, способствующих развитию и прогрессированию глаукомной оптической нейропатии.
Нейропротекторная терапия
Современные знания об этиопатогенетических механизмах развития глаукомы утвердили экспертов во мнении, что это мультифакториальное заболевание носит нейродегенеративный характер и у него много общего, к примеру, с болезнями Альцгеймера и Паркинсона.
Глаукомная оптическая нейропатия (ГОН) – термин, пожалуй, отражающий современный этап в понимании процессов поражения зрительного анализатора при глаукоме. ГОН формируется под действием многих факторов, приводящих к апоптозу ганглиозных клеток сетчатки. Здесь и механическое нарушение аксонального тока, вызванное повышенным ВГД; и нарушение кровоснабжения ГЗН; и избыток свободных радикалов, связанный с ишемией и усилением перекисного окисления липидов.15-16
Как показали исследования, прогрессирующая оптиконейропатия – патологические изменения полей зрения и гибель ганглиозных клеток сетчатки, поэтому наряду с гипотензивным компонентом в терапии пациента с этой офтальмопатологией необходим нейропротекторный.17
Современная офтальмология располагает разнообразными ЛС с нейропротекторным действием. Это и нейропротекторы прямого действия. Они непосредственно защищают нейроны сетчатки и волокна зрительного нерва, блокируя прямые факторы клеточного повреждения (увеличение концентрации продуктов перекисного окисления липидов и свободных радикалов, ионов Са++). И нейропротекторы непрямого действия, опосредованно оказывающие защитное действие и повышающие устойчивость различных функциональных систем к снижению перфузионного давления в сосудах глаза и гипоксии (препараты, улучшающие микроциркуляцию, реологические свойства крови, снижающие уровень холестерина в крови, ноотропные средства).
Среди основных средств нейропротекторной терапии – антагонисты NMDA-рецепторов, антиоксиданты, препараты пептидной структуры, блокаторы кальциевых каналов, альфа-2 агонисты, ингибиторы карбоангидразы, аналоги простагландинов и др.
В Федеральных рекомендациях10 обращается внимание врачей на никотиновый эфир ГАМК – препарат Пикамилон. Это первое отечественное оригинальное средство с ноотропной активностью, синтезированное еще в 1969 г. во Всесоюзном научно-исследовательском витаминном институте и изученное в НИИ фармакологии РАМН.
Благодаря своему происхождению Пикамилон имеет свойства как ГАМК (тормозного медиатора центральной нервной системы), так и никотиновой кислоты (обладающей сосудорасширяющим эффектом). Он быстро всасывается из желудочно-кишечного тракта, в отличие от ГАМК легко проникает через гематоэнцефалический барьер (ГЭБ). Ему свойственно ноотропное (улучшение метаболизма и функции головного мозга) и непродолжительное сосудорасширяющее действие.19
За годы его применения (внедрен в 1986 г.) накоплена значительная доказательная база его эффективности. Пикамилон показал себя как средство метаболической терапии, сочетающее выраженные вазоактивные свойства, ноотропное действие и транквилизирующий эффект.
Без труда проникая через ГЭБ, Пикамилон влияет на механизмы нейровазомоторной регуляции, стимулируя мозговое кровообращение (обусловлено понижением тонуса сосудов мозга в системе каротидных и позвоночных артерий, пиальных артериол, увеличением объемной скорости мозгового кровотока, выраженным центральным депримирующим воздействием на рефлекторные сократительные реакции мозговых сосудов и соматосимпатические рефлексы). По мере накопления ГАМК в тканях головного мозга постепенно оптимизируются механизмы синаптической передачи и нормализуются нейродинамические процессы в центральной нервной системе. Благодаря этому формируются положительные адаптационные перестройки в сложнейшей морфофункциональной системе зрительного анализатора.20
Пикамилон обладает следующими свойствами:
- улучшает продуктивность мозговой деятельности;
- повышает выносливость по отношению к умственным нагрузкам;
- оказывает антиоксидантное действие;
- улучшает микроциркуляцию крови внутри глаз.
Вот одно из многочисленных исследований Пикамилона. Его провели в ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (профессор А.А. Рябцева), где под наблюдением находилось 116 пациентов (в возрасте от 56 до 80 лет).20 Все больные (со схожими показателями заболевания и жалобами) получали местную гипотензивную терапию в инстилляциях в оба глаза (тимолол 0,5% 2 раза в день и бринзоламид 1 раз в день). Но часть пациентов (2-я группа) получала Пикамилон в дозе 50 мг 2 раза в день в течение 1,5 мес. Эффективность проведенного лечения оценивали по динамике остроты зрения, периметрии, показателям электрофизиологических исследований и по картине глазного дна.
Этот опыт применения Пикамилона в качестве средства метаболической терапии показал его положительное влияние на гидродинамические показатели глаза у больных с ПОУГ: снижение истинного ВГД, увеличение коэффициента легкости оттока, увеличение секреции внутриглазной жидкости, снижение коэффициента Беккера. Исследователи отметили достоверное улучшение остроты зрения (ОЗ) с 0,37 ± 0,04, до 0,44 ± 0,05 у пациентов группы Пикамилона. А также после курса приема Пикамилона выявили тенденцию к повышению световой чувствительности (или снижению времени темновой адаптации), что свидетельствовало о возрастании функциональной активности сетчатки и зрительного нерва. Рекомендуемая длительность курсового приема Пикамилона – от 1,5 до 3 месяцев.
Таким образом, одна из важнейших проблем офтальмологии – лечение пациентов с первичной открытоугольной глаукомой – требует от врача комплексного подхода, включающего не только терапию, направленную на нормализацию внутриглазного давления, но и нейропротекторную, позволяющую сохранить еще не погибшие, но уже испытывающие губительное влияние ишемии аксоны ганглионарных нервных клеток. Для коррекции нарушений функционального состояния зрительного анализатора может успешно применяться отечественный препарат Пикамилон, проверенный в многолетней клинической практике российскими врачами и доступный (в том числе и по цене) их пациентам.
Список литературы
1Нероев В.В. Организация офтальмологической помощи населению Российской Федерации. Вестник офтальмологии. 130 (6), 2014, с. 8–12.
2Quigley H.A., Broman A.T. The number of people with glaucoma worldwide in 2010 and 2020. British Journal of Ophthalmology. 2006, vol. 90, p. 262–267.
3Goldberg I. Glaucoma in the 21st Century. I. Goldberg // Hartcourt. Health Communication / London: Mosby Int., 2000, p. 4–8.
4Либман Е.С. Доклад на съезде офтальмологов России, 2005/Е.С. Либман // Газета «Окулист». № 4, 2005, с. 1.
5Либман Е.С. Эпидемиологическая характеристика глаукомы / Е.С. Либман // Глаукома. № 1, 2009, с. 2–3.
6Нероев В.В., Авдеев Р.В., Киселева О.А., Бессмертный А.М. Отдельные результаты эпидемиологического исследования по глаукоме за 2011 год. Офтальмологические ведомости. Т. 7, № 2, 2014, с. 4–8.
7Tham Y.C., Li X., Wong T.Y., Quigley H.A., Aung T., Cheng C.Y. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology. 2014, 121, p. 2081–2090.
8Аликова Т.Т., Аликова З.Р., Фидарова К.К., Яхъяева З.И. Уровень заболеваемости глаукомой и диспансерного наблюдения за больными: региональные особенности. Международный журнал прикладных и фундаментальных исследований. № 8-2, 2020, с. 149–152.
9Нестеров А.П. Патогенез и проблемы патогенетического лечения глаукомы // Клиническая офтальмология. № 4 (2), 2003, с. 47–49.
10Нестеров А.П. Глаукома. – М. ООО «Медицинское информационное агентство», 2008. 360 с.
11Marjanovic I., Milic N., Martines A. The impact of intraocular pressure reduction on retrobulbar hemodinamic parameters in patients with open-angle glaucoma // Eur. J. Ophthalmol. 2012, № 225 (1), p. 77–82.
12Osborne N.N., Wood J.P., Chidlow G. et al. Ganglion cell death in glaucoma: what do we really know? // Br. J. Ophthalmol. 1999, vol. 83, № 8, p. 980–986.
13Еричев В.П. Гипотензивная терапия первичной открытоугольной глаукомы фиксированными комбинациями лекарственных средств (методич. рекомендации). М. Апрель, 2012, 21 с.
14Федеральные клинические рекомендации. Глаукома первичная открытоугольная. 2020. https://bz.medvestnik.ru/nosology/Pervichnaya-otkrytougolnaya glaukoma.html/recomendations/classification.
15Osborne N.N., Wood J.P., Chidlow G. et al. Ganglion cell death in glaucoma: what do we really know? Br. J. Ophthalmol. 1999, vol. 83, № 8, p. 980–986.
16Курышева Н.И. Глаукомная оптическая нейропатия. М. МЕДпресс-информ, 2006. 136 с.
17Егоров Е.А., Брежнев А.Ю., Егоров А.Е. Нейропротекция при глаукоме: современные возможности и перспективы. РМЖ «Клиническая Офтальмология» № 2 от 29.05, 2014, с. 108.
18Пикамилон – метаболический цереброваскулятор и ноотроп. Применение в лечебной практике. Москва. 2002, 48 с.
19Рациональная фармакотерапия в офтальмологии. Руководство для практикующих врачей. Под общ. ред. Е.А. Егорова. М., Литера. 2004, с. 435.
20Рябцева А.А. Опыт нейрометаболического лечения первичной открытоугольной глаукомы: подходы к стабилизации зрительных функций. https://medvestnik.ru/content/medarticles/Opyt-neirometabolicheskogo-lecheniya-pervichnoi-otkrytougolnoi-glaukomy-podhody-k-stabilizacii-zritelnyh-funkcii.html.