Активное наблюдение
Активное наблюдение — наблюдение за опухолью с регулярными диагностическими обследованиями и посещениями клиники. Оно эффективно у пожилых пациентов и пациентов, имеющих небольшую опухоль почки и другое серьезное заболевание (сердца, легких, хроническое заболевание почек), которое препятствует противоопухолевому лечению или увеличивает связанный с ним риск осложнений.
У некоторых пациентов с раком почек активное наблюдение используется до тех пор, пока они имеют минимальные симптомы (или вообще не имеют симптомов), даже если рак распространился на другие части тела. Прогрессирование заболевания и ухудшение состояния пациента — повод начать системную терапию.
Хирургические методы лечения
Хирургический метод лечения — это удаление опухоли и некоторых окружающих здоровых тканей во время операции. Если рак не распространился за пределы почек, единственным необходимым лечением может быть операция по удалению опухоли, части почки или всей почки и, возможно, близлежащих тканей и лимфатических узлов.
Типы операций при раке почки
Радикальная нефрэктомия. Обычно проводится при лечении большой опухоли, когда здоровой ткани почки остается мало: удаляется опухоль, пораженный орган и окружающие ткани. Если болезнь затрагивает близлежащие ткани и окружающие лимфатические узлы, проводится радикальная нефрэктомия и удаление лимфатических узлов. Если рак распространился на надпочечник или близлежащие кровеносные сосуды, хирург может удалить надпочечник (адреналэктомия) и части кровеносных сосудов. Иногда опухоль почки растет непосредственно внутри почечной вены, и на пути к сердцу опухолевый тромб может прорастать в полую вену. В этом случае для безопасного удаления всех опухолевых изменений необходимы сложные сердечно-сосудистые хирургические вмешательства.
Частичная нефрэктомия. Хирургическое удаление опухоли и части здоровой ткани почки. Этот вид хирургического вмешательства сохраняет функции почек и снижает риск развития хронических заболеваний почек после операции. Исследования показали, что частичная нефрэктомия эффективна при опухолях T1 во всех случаях, когда операция возможна.
Лапароскопическая и роботизированная хирургия (минимально инвазивная хирургия). Во время лапароскопической операции доступ к органам осуществляется через несколько небольших проколов брюшной стенки. Через эти проколы хирург вводит лапароскопические инструменты для полного удаления почки или выполнения частичной нефрэктомии. Иногда при проведении операции хирург может использовать роботизированные инструменты. Роботизированная хирургия может занять больше времени, но менее травматична. Лапароскопический и роботизированный подходы требуют специальной подготовки. Важно заранее обсудить потенциальные преимущества и риски таких операций с хирургом и быть уверенным в том, что у хирургической команды есть опыт их проведения.
Нехирургическое лечение опухолей
Иногда хирургическое лечение не показано из-за особенностей опухоли или общего состояния здоровья пациента. В таких случаях могут быть рекомендованы следующие манипуляции:
Радиочастотная аблация (РЧА). Удаление патологически измененных тканей методом выжигания электрическим током определенной частоты. Процедура выполняется интервенционным радиологом или урологом. Пациенту вводят седативный препарат и проводят местную анестезию для обезболивания.
Криоаблация (криотерапия или криохирургия). Замораживание раковых клеток с помощью металлического зонда, который помещают в опухолевую ткань через небольшой разрез. Для направления зонда используется компьютерная томография и ультразвук. Процедура требует общей анестезии в течение нескольких часов и выполняется интервенционным радиологом. Некоторые хирурги комбинируют криоаблацию с лапароскопическим удалением опухоли, хотя полномасштабных исследований по этой теме не проводилось, соответственно полных и достоверных данных, доказывающих эффективность такой методики, пока нет.
Системная терапия
Системная терапия — это использование лекарственных препаратов для уничтожения раковых клеток. Медикаменты принимаются перорально или вводятся внутривенно, с током крови они распространяются по всему телу и воздействуют на раковые клетки. Системную терапию обычно назначает онколог, врач, специализирующийся на лечении рака с помощью лекарств.
Типы системной терапии для лечения рака почки: таргетная терапия, иммунотерапия, химиотерапия. Пациент может получать один вид системной терапии или комбинацию лекарств. Препараты системной терапии также могут использоваться в рамках лечения, которое включает в себя хирургическую и/или лучевую терапию.
Таргетная терапия
Таргетная терапия — лечение, направленное на конкретные «мишени» в опухоли: гены, белки и рецепторы клеточных мембран, способствующие росту и выживанию раковой клетки. Этот вид лечения блокирует рост и распространение раковых клеток, минимально повреждая здоровые клетки.
Виды таргетной терапии рака почек:
Антиангиогенная терапия. Этот вид лечения направлен на прекращение ангиогенеза — процесса создания новых кровеносных сосудов. Большинство клеток рака почек имеют мутации гена VHL, которые приводят к тому, что рак производит большое количество определенного белка, известного как фактор роста эндотелия сосудов (VEGF). VEGF контролирует образование новых кровеносных сосудов, поскольку опухоль нуждается в питательных веществах, доставляемых током крови для ее роста и распространения. Целью антиангиогенной терапии является блокировка фактора роста сосудов для обеспечения «голодания» опухоли. Существует 2 способа блокирования VEGF: с помощью ингибиторов VEGF-рецепторов (VEGFR) или с помощью антител, направленных против этих рецепторов.
Установлено, что рекомбинантные гиперхимерные гуманизированные моноклональные антитела (бевацизумаб, Авастин) способны замедлять рост опухоли у пациентов с метастатическим почечно-клеточным раком. Бевацизумаб в комбинации с интерфероном замедляет как рост, так и процесс метастазирования опухоли.
Другой способ блокировки VEGF — ингибиторы тирозинкиназы (ИТК). Ингибиторы тирозинкиназы, используемые для лечения светлоклеточного ПКР, представлены препаратами акситиниб (Инлита), кабозантиниб (Кабометик, Кометрик), пазопаниб (Вотриент), сорафениб (Нексавар) и сунитиниб (Сутент). Общими побочными эффектами ИТК могут быть диарея, высокое артериальное давление, кожная сыпь, ладонно-подошвенный синдром.
Ингибиторы mTOR. Препараты эверолимус (Афинитор) и темсиролимус (Торисел) нацелены на определенный белок mTOR, который помогает расти клеткам рака почки. Исследования показывают, что эти лекарства замедляют рост рака почек.
Комбинированная терапия. В 2021 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило 2 комбинации препаратов для первой линии лечения распространенного почечно-клеточного рака.
Первая комбинация включает в себя антиангиогенный препарат акситиниб и ингибитор иммунных контрольных точек пембролизумаб (подробнее читайте в параграфе «Иммунотерапия» ниже). Во второй комбинации используются акситиниб и ингибитор иммунных контрольных точек авелумаб.
Пембролизумаб и авелумаб нацелены на путь PD-1, активирующий иммунную систему для атаки на клетки рака. Эти комбинации лечения работают независимо от того, экспрессирует ли опухоль белок PD-L1, поэтому пациенты, получающие эту терапию, не тестируются на экспрессию гена PD-L1.
На консультации с онкологом клиники Рассвет вы можете обсудить возможные побочные эффекты конкретного лекарства и получить рекомендации, как с ними справляться.
Иммунотерапия
Иммунотерапия (биологическая терапия) предназначена для усиления естественной иммунной защиты организма в борьбе против рака.
Интерлейкин-2 (ИЛ-2, Пролейкин). Вид иммунотерапии для лечения рака почек поздней стадии. Это цитокин, белок, который вырабатывается лейкоцитами. Он используется иммунной системой, в том числе для разрушения опухолевых клеток.
Высокие дозы IL-2 могут вызывать тяжелые побочные эффекты — пониженное артериальное давление, повреждение легких, почек, сердечной мышцы, кровотечение, озноб и лихорадку, поэтому в некоторых случаях лечение целесообразно проводить в стационаре. Рекомендовать высокодозированное лечение рака почек IL-2 должны только центры, имеющие такой опыт. Некоторые центры используют низкие дозы IL-2, что приводит к меньшему количеству побочных эффектов, однако такое лечение менее эффективно.
Альфа-интерферон. Альфа-интерферон используется для лечения распространенного рака почек. Установлено, что он менее эффективен, чем IL-2, но увеличивает продолжительность жизни пациентов в сравнении с более старым методом лечения, препаратом мегестрол ацетат (мегацетат).
Ингибиторы иммунных контрольных точек. Эффективность применения этого типа иммунотерапии для лечения рака почек продолжают исследовать. FDA одобрило комбинацию из двух иммунных ингибиторов — ниволумаба (Опдиво) и ипилимумаба (Ервой) для терапии распространенного почечно-клеточного рака у пациентов, ранее не получавших лечения. Дополнительные исследования показали, что ниволумаб, вводимый в виде одного препарата внутривенно каждые 2 недели, также был эффективен у некоторых пациентов, которые раньше получали лечение. Продолжительность жизни этих пациентов была дольше, по сравнению с теми, кто получал таргетную терапию эверолимусом. Другая одобренная к применению комбинация включает ингибиторы контрольных точек пембролизумаб или авелумаб и таргетный препарат акситиниб — в качестве первой линии терапии пациентов с распространенным почечно-клеточным раком. В настоящее время проводится множество клинических испытаний для дальнейшего исследования иммунных препаратов в лечении рака почек.
Различные типы иммунотерапии могут вызывать побочные эффекты. К наиболее частым побочным эффектам относятся кожные реакции, гриппоподобный симптом, диарея и потеря веса.
Химиотерапия
Химиотерапия — это медикаментозный метод воздействия на раковые клетки. Химиопрепараты блокируют возможность деления и образования большего количества раковых клеток, что приводит к замедлению роста опухоли и ее гибели.
Химиотерапевтические препараты применяются циклами, с определенными интервалами. Обычно за днями введения или приема препаратов следуют дни отдыха. Благодаря таким перерывам организм успевает восстановиться. Дни применения препарата и дни отдыха составляют один цикл.
Комбинация нескольких химиотерапевтических препаратов с указанием методов введения и длительностью цикла называется режимом химиотерапии.
Хотя химиотерапия успешно применяется для лечения многих видов рака, в большинстве случаев рак почки к ней устойчив. Исследования новых лекарств и новых комбинаций препаратов продолжаются. У некоторых пациентов комбинация гемцитабина (Гемзар) с капецитабином (Кселода) или 5-фторурацилом позволяет временно уменьшить размеры опухоли.
Важно помнить, что переходно-клеточный рак (уротелиальный) и опухоль Вильмса более эффективно поддаются химиотерапевтическому лечению.
Побочные эффекты химиотерапии зависят от общего состояния пациента и используемой дозы, они могут включать слабость, тошноту и рвоту, выпадение волос, потерю аппетита и диарею. Эти побочные эффекты обычно проходят после окончания лечения.
Подробнее
Химиотерапия
Препараты таргетной терапии рака почки первой линии
В основном данные виды лекарств используются, чтобы уменьшить или контролировать течение болезни при распространенном опухолевом процессе. По результатам исследований и отзывам таргетная терапия рака почек останавливает или замедляет развитие болезни на нескольких месяцев, а иногда — лет.
Обычно лекарственные средства принимают, пока они способны контролировать заболевание. Пациент встречается с врачом каждые 4-6 недель, также сдает анализы крови. Раз в три месяца выполняется сканирование, что выяснить, результативно ли лечение.
Рассмотрим схемы таргетной терапии рака почки. Сунитиниб (Сутент) в основном рекомендуют первым при наличии вторичных очагов. Другой распространенный препарат — Пазопаниб (Pazopanib). Эти лекарства блокируют сигналы о росте в злокачественных клетках и называются ингибиторами тирозинкиназы. Также в ряде случаев назначают сорафениб (Nexavar).
Сунитиниб (Sunitinib)
Сунитиниб имеет другие название — сутент. Его используют на 3 или 4 стадии заболевания. Принимается в капсулах, ежедневно на протяжении 4-х недель с последующим перерывом в 2 недели.
Этот препарат относится к группе ингибиторов тирозинкиназы. Он блокирует внутриклеточные белки под названием тирозинкиназы в опухолевых клетках, которые дают сигналы к росту и делению, связывают клетки с ядром и клеточными структурами. Помимо этого, сутент препятствует кровоснабжению, лишая патологические клетки поступления питательных веществ и кислорода.
Возможные нежелательные последствия приема включают усталость, повышенный риск инфекции в связи с низким уровнем лейкоцитов, анемию, изменения вкусовых ощущений, диарею, кожную сыпь и зуд, ладонно-подошвенную кератодермию, артериальную гипертензию. Сунитиниб может ухудшить работу щитовидной железы, по этой причине больной регулярно сдает анализы крови, чтобы проверить это.
Пазопаниб (Pazopanib)
Пазопаниб – ингибитор роста рака, врач может порекомендовать препарат в качестве первичного лечения при распространенном опухолевом процессе и как вторичное после применения интерферона или интерлейкина-2. Выпускается в таблетках, его принимают каждый день. К потенциальным отрицательным последствиям приема относят: диарею, ладонно-подошвенную кератодермию, сыпь и зуд кожи, повышенную утомляемость, тошноту.
Лучевая терапия
Лучевая терапия — это использование высокоэнергетических рентгеновских лучей или других частиц для разрушения раковых клеток.
Лучевая терапия неэффективна для первичного лечения рака почек. Она используется только в том случае, если пациенту нельзя провести хирургическое лечение — как правило, на зоны, куда метастазировал рак, а не на область первичной опухоли. Это лечение проводится для облегчения симптомов, таких как боль в костях на фоне метастатического процесса.
Поддерживающая (паллиативная) терапия
Паллиативная терапия — это специализированная медицинская помощь, направленная на облегчение боли и других симптомов серьезного заболевания. Специалисты по паллиативной терапии работают с пациентом, его семьей и сотрудничают с другими врачами, чтобы обеспечить дополнительный уровень поддержки, дополняющий текущий уход.
Когда паллиативный уход используется вместе со всеми другими соответствующими видами лечения, больные раком чувствуют себя лучше и живут дольше.
Паллиативная помощь в клинике Рассвет предоставляется командой врачей, медсестер и других специально обученных сотрудников. Команды паллиативной помощи стремятся улучшить качество жизни людей с онкологическими заболеваниями. Эта форма ухода предлагается наряду с лечебными или другими видами лечения.
Потенциальные побочные эффекты таргетной терапии
Врачи больницы Асаф ха-Рофэ подбирают лечение на основе высокоточных генетических тестов, сводя к минимуму нежелательные последствия лечения.
Для управления и контроля побочными эффектами используются многочисленные современные методики, снижающие или предупреждающие их.
- Усталость. Прием данных лекарственных средств становится причиной значительной усталости, что мешает повседневной деятельности и сну. Возможные причины: депрессия, снижение аппетита, анемия, конкретные препараты, низкий уровень гормонов щитовидной железы, накопление токсических отходов в связи с лечением и отмиранием патологических клеток.
- Диарея. Лекарства таргетной терапии часто воздействуют на клетки желудочно-кишечного тракта. Также вероятность этого нежелательного явления способны увеличить тип и доза лекарств.
- Рвота и тошнота. Эти симптомы обычно отмечают в первые несколько часов после приема лекарств, могут сохраняться на протяжении суток.
- Утрата аппетита наблюдается в ходе таргетной терапии. Воздействующими факторами на данное проявление являются рвота, усталость, тошнота, скопление отходов в организме.
- Гипертония — высокое кровяное давление может быть вызвано таргетной терапией. Врачи регулярно проверяют артериальное давление в процессе лечения. В случае необходимости назначают лекарства, понижающие его.
- У некоторых людей в ходе таргетной терапии рака почки может наблюдаться одышка.
- Воспалительный процесс в полости рта бывает, что вызывает прием сунитиниба. Отмечается в течение одной — двух недель после начала терапии. Пациента консультируют по поводу тщательного и регулярного ухода за полостью рта, что может помочь предотвратить воспаление и уменьшить вероятность инфекции. Для облегчения боли назначают анальгетики.
- Таргетная терапия рака почки способна спровоцировать ладонно-подошвенный синдром. Симптомы его включают боль, отек, покраснение, покалывание, жжение и шелушение кожи на руках или ногах или на обеих конечностях.
- Изменения кожного покрова под действием лечения охватывает следующие признаки: покраснение, сухость, сыпь, зуд, шелушение, образование пузырей и мозолей, акне, изменения ногтей.
- Проблемы с пищеварением могут возникнуть под действием таргетной терапии рака почек: изжога, газообразование, вздутие живота, боли в желудке. Безрецептурные препараты, принимаемые для улучшения пищеварения, такие как ранитидин или омепразол, могут создавать помехи для некоторых средств таргетной терапии. Важно поговорить с лечащим врачом, прежде чем принимать эти лекарства.
- Некоторые таргетные препараты могут снизить количество тиреотропного гормона (ТТГ), вырабатываемого гипофизом. Этот гормон дает сигнал щитовидной железе производить гормоны, контролирующие обмен веществ. Признаки и симптомы пониженной функции щитовидной железы включают: усталость, слабость, нетерпимость к холоду, мышечные боли и судороги.
- Во время таргетной терапии рака почки проводятся регулярно анализы крови, чтобы выявить низкий ТТГ. В случае необходимости назначаются лекарства, корректирующие его количество.
- Проблемы с сердцем. Некоторые таргетные препараты могут вызвать повреждение сердца. Выполняются ЭКГ и другие тесты, проверяющие функцию сердца перед началом лечения, особенно если имели место болезни сердца до этого.
- Изменение биохимического анализа крови возможно под действием данной терапии: высокий уровень сахара, повышенное количество холестерина, сниженное содержание фосфатов в крови (вызывает слабость, дрожь, спутанность сознания).
- Подавление костного мозга — состояние, при котором уменьшается количество клеток крови — лейкоцитов, тромбоцитов или эритроцитов, что повышает риск инфекции, развития гематом и кровотечений, анемии.
- Интерстициальный пневмонит представляет собой тип пневмонии, который развивается в соединительной ткани легкого. Эверолимус может стать причиной неинфекционной пневмонии.
- Истончение волос или их выпадение часто вызывает прием препарата сорафениб и пазопаниб. Волосяные фолликулы являются уязвимыми к действию средств таргетной терапии рака почки, поскольку быстро растут. Степень и длительность побочного эффекта непредсказуема, но волосы отрастают, как правило, после лечения.
Метастатический рак почки
Метастатический рак — это злокачественная опухоль, распространяющаяся в другие органы и ткани при помощи метастазов.
Рак почек чаще всего метастазирует в легкие, но может распространиться и в лимфатические узлы, кости, печень, мозг, кожу и другие участки тела. Это системное заболевание, которое требует системной терапии — таргетной или иммунотерапии. Иногда при наличии метастазов проводится удаление пораженной опухолью почки (циторедуктивная нефрэктомия). Эта операция предотвращает боль и кровотечение во время системного лечения. При раке почки, распространившемся на какой-то один орган (например, единичный метастаз в легком), может быть проведено хирургическое удаление этого поражения (метастазэктомия). Такая операция способствует увеличению продолжительности жизни у некоторых пациентов. Если рак распространился на множество органов или тканей за пределами почки, лечить его труднее. Хирургия в этом случае не помогает, вместо нее проводится системная терапия.
Наиболее эффективные методы лечения метастатического рака почек сегодня — комбинации иммунных препаратов, активирующие иммунную систему для уничтожения раковых клеток. Они продлевают жизнь по сравнению со стандартным лечением. Паллиативная медицина также важна для облегчения симптомов и побочных эффектов.
В каких случаях при раке почек назначают таргетную терапию?
Основное показание к назначению таргетных препаратов при злокачественных опухолях почек — неэффективность химиотерапии. Таргетная терапия часто применяется при запущенных злокачественных опухолях на поздних стадиях. Она не предназначена для того, чтобы вылечить рак, но может уменьшить размеры опухоли, замедлить ее рост — это помогает увеличить продолжительность жизни пациента.
Другая сфера применения таргетных препаратов при раке почки — в качестве адъювантной терапии после хирургического лечения. Препарат под названием сунитиниб помогает предотвратить рецидив.
Таргетные препараты при раке почки назначают, как правило, в режиме монотерапии. Одни из них нужно принимать в таблетках, другие вводят внутривенно. Если препарат не работает, его отменяют и назначают другой.
Таргетная терапия при злокачественных опухолях почек пока изучена недостаточно, нельзя сказать, какое лекарство будет работать лучше всего в данном случае, стоит ли их комбинировать, чтобы усилить эффект, и если стоит, то как это правильно делать. Эти нюансы еще предстоит выяснить в ходе исследований.
Написать врачу-онкологу
Ремиссия и рецидив
Ремиссия — улучшение состояния пациента после лечения, характеризующееся прекращением проявления болезни: отсутствием симптомов опухолевого поражения и признаков рака при обследовании.
Ремиссия может быть временной или постоянной. Эта неопределенность заставляет многих пациентов беспокоиться, что рак вернется (рецидив).
Понимание риска рецидива и возможных вариантов лечения помогает пациенту чувствовать себя более уверенно.
На консультации онколога в клинике Рассвет вы можете получить необходимую информацию о прогнозе вашего заболевания, это поможет эффективнее справляться со страхом возврата болезни.
Рак может повторно развиться в области первичной опухоли (местный рецидив), в области, находящейся в непосредственной близости с первичным очагом (региональный рецидив) или в другой области (удаленный рецидив). Если ранее пациенту проводилось частичное удаление почки, в той же почке может образоваться новая опухоль. Рецидивирующую опухоль можно удалить с помощью частичной нефрэктомии или радикальной нефрэктомии.
При рецидиве начинается новый цикл обследований, чтобы узнать как можно больше о распространении рака. Часто план лечения включает в себя методы, описанные выше: хирургию, таргетную терапию или иммунотерапию. Но они могут использоваться в другой комбинации или другом режиме. Независимо от плана лечения паллиативная терапия будет важна для облегчения симптомов и побочных эффектов.
Люди с рецидивирующим раком часто испытывают негативные эмоции, недоверие или страх. В клинике Рассвет вы можете обсудить эти проблемы с психологом и научиться справляться с ними лучше.
Поддержка больных
Также при борьбе с раковыми заболеваниями одной из ключевых задач врача и самого пациента является формирование положительного психоэмоционального фона. Независимо от того, какой метод воздействия избран, будь то таргетная терапия или облучение раковых клеток, недопустимо настраиваться на отрицательный результат.
Квалифицированные специалисты способствуют улучшению настроения и общего самочувствия пациентов следующим образом:
- назначают медикаменты, которые позволяют справиться с сопутствующими патологиями;
- вводят антипсихотические препараты;
- назначают обезболивающие средства, устраняющие болевой синдром при необходимости;
- устанавливают контроль реаниматологов, постоянно следящих за гомеостазом и другими показателями организма;
- назначают физиотерапевтические процедуры и т.д.
При этом больной должен постоянно находиться в благоприятных условиях. Насколько бы эффективна ни была таргетная терапия – положительный настрой вносит весомый вклад в конечный результат лечебного процесса.
Наблюдение после лечения
Наблюдение за пациентами с онкологическими заболеваниями продолжается и после завершения активного лечения. Оно может включать в себя регулярные физические обследования и медицинские анализы, направленные в том числе на исключение рецидива.
Рекомендации по наблюдению пациента зависят от нескольких факторов, включая тип, стадию рака и вид проведенного лечения. Пациентам, которые прошли хирургическое лечение рака почек, часто необходимо контролировать функцию почек до конца жизни.
Команда врачей онкологического отделения клиники Рассвет продолжает наблюдать за пациентом после лечения. Мы не только проводим обследования на рецидив заболевания, но и оказываем помощь в устранении побочных эффектов и следим за вашим общим состоянием здоровья.
Опыт применения таргетных препаратов у больных метастатическим раком почки
В статье представлен опыт лечения больных метастатическим раком почки с использованием таргетной терапии. Предлагается определять стратегию терапии, учитывая не только рекомендации по очередности назначения таргетных препаратов в зависимости от прогноза заболевания, но и индивидуальные реакции больного, а также эффективность препаратов в каждом конкретном случае.
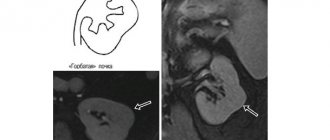
Рис. 1. Множественные метастазы в легкие, метастаз в единственную левую почку
Рис. 2. Метастаз в мягкие ткани
Лечение больных раком почки является одной из актуальных проблем онкоурологии. Рак почки занимает ведущее место в структуре онкоурологических заболеваний, а по темпам прироста заболеваемости стоит на втором месте среди онкологических заболеваний. В России за 2011 г. выявлено около 20 тысяч больных со злокачественными новообразованиями почки [1].
Основным методом лечения рака почки остается хирургический, но, по данным статистики, у большого количества больных, перенесших радикальные операции, в последующем диагностируется прогрессирование заболевания. В последние годы использование таргетных препаратов позволило достичь безусловных успехов в лечении пациентов с метастатическим раком почки. Быстро развивающаяся практика лечения таргетными препаратами дает надежду тяжелой категории больных метастатическим раком почки на продление жизни и улучшение контроля над заболеванием.
Несмотря на то что уже существуют рекомендации последовательного назначения таргетных препаратов с учетом прогноза заболевания, в большом количестве случаев приходится подбирать терапию индивидуально, оценивая эффективность препарата и реакции каждого больного. Проиллюстрируем эти утверждения конкретными клиническими примерами.
Клинический случай 1
Этот клинический случай представляет, на наш взгляд, типичный пример развития заболевания у больных раком почки.
Больной А., диагноз: «рак правой почки Т3N0M0».
Диагноз установлен в ноябре 2011 г. при обследовании по поводу жалоб на боли в правом подреберье. Компьютерная томография (КТ) показала опухоль в правой почке 90 × 70 мм с прорастанием капсулы почки. Радикальная нефрэктомия справа произведена 14.02.2012. Гистологическое заключение № 7417-33/12-10: почечно-клеточный светлоклеточный рак.
В октябре 2012 г. на КТ выявлено прогрессирование заболевания: метастазы в легкие, внутригрудные лимфоузлы. Статус по шкале оценки общего состояния онкологического больного Восточной объединенной группы онкологов (Eastern Cooperative Oncology Group, ECOG) 0–1, прогноз расценен как неблагоприятный. С учетом гистологического типа опухоли больному назначена таргетная терапия сунитинибом 50 мг/сут с 28.11.2012. Лечение переносил удовлетворительно. Побочные эффекты были выражены умеренно (1-я степень), в основном они проявлялись кожной токсичностью и изжогой. Больной получал терапию антацидами с положительным эффектом. С целью коррекции кожных реакций были назначены увлажняющие кремы. Уменьшения дозы препарата не потребовалось. Больной продолжил лечение.
Контрольное обследование (КТ органов грудной и брюшной полости) через два месяца показало уменьшение размеров очагов в легких. Новые очаги не выявлены. Это было расценено как частичный ответ на проводимую терапию.
При последующих контрольных обследованиях признаков прогрессирования заболевания не определялось. Больной получает терапию сунитинибом по настоящее время (в течение 12 месяцев), переносимость оценивается как хорошая. С учетом хорошего клинического эффекта проводимой терапии и умеренных токсических проявлений решено продолжить терапию сунитинибом в дозе 50 мг/сут.
Клинический случай 2
Больной Т., 1950 г.р. Рак правой почки Т2N0M0, диагноз установлен в 2002 г.
30.05.2002 выполнена радикальная нефрэктомия справа. Гистологическое заключение: светлоклеточный почечно-клеточный рак. Послеоперационный период протекал без осложнений. В дальнейшем проводилось динамическое наблюдение за пациентом.
В апреле 2010 г. больной отметил появление кровянистых выделений из полости носа. При осмотре у оториноларинголога в поликлинике заподозрена опухоль левой половины носовой полости. Больной поступил в лор-отделение онкологического стационара для морфологической верификации диагноза. На момент поступления в стационар у больного в связи с участившимися носовыми кровотечениями отмечалась анемия 1-й степени. При неоднократных попытках пункции опухоли левой половины носа гистологический материал получен не был, установить морфологию опухоли не удалось. Продолжала усугубляться анемия (гемоглобин 92 г/л). Больному была выполнена передняя тампонада левой половины носовой полости. По данным КТ органов грудной клетки и брюшной полости определены множественные метастазы в легкие, метастаз в единственную левую почку (рис. 1).
Больной выписан под наблюдение онколога по месту жительства с рекомендациями симптоматической терапии. Несмотря на то что морфологического материала получено не было, опухоль в носовой полости, очаговые образования в легких и опухоль в единственной левой почке были расценены как метастазы почечно-клеточного рака. Единственным вариантом лечения на тот момент в условиях онкодиспансера была иммунотерапия интерфероном, который и был назначен больному в дозе 6 млн ЕД 3 раза в неделю подкожно.
Лечение больной переносил удовлетворительно, отметил значительное уменьшение кровянистых выделений из полости носа. Боли уменьшились. Признаков увеличения опухолевых очагов в легких и единственной левой почке не было выявлено. Однако полностью кровянистые выделения не прекратились, что сопровождалось снижением уровня гемоглобина до 87 г/л. С целью коррекции анемии были назначены эритропоэтины и препараты железа, а также продолжена гемостатическая терапия. Это дало положительный эффект: уровень гемоглобина поднялся до 95 г/л.
В марте 2011 г. больной был срочно госпитализирован в стационар с профузным носовым кровотечением. По жизненным показаниям 05.03.2011 выполнена перевязка наружной сонной артерии слева. Кровотечение остановлено. На момент госпитализации лечение интерфероном продолжалось в течение 10 месяцев.
24.03.2011 выполнена электрорезекция опухоли левой половины носовой полости. При гистологическом исследовании выявлена хемодектома с поверхностным некрозом новообразования. Препараты были отправлены на иммуногистохимическое исследование, по результатам которого установлена принадлежность опухоли к светлоклеточному почечно-клеточному раку. С учетом данных гистологии больному назначена таргетная терапия бевацизумабом и интерфероном с июля 2011 г. Статус по ECOG – 0–1. Лечение переносил удовлетворительно. Так как носовые кровотечения были купированы, уровень гемоглобина повысился до 132 г/л. Терапия продолжалась в течение 5 месяцев.
В ноябре 2011 г. выявлены метастазы во внутригрудные лимфоузлы (по данным КТ органов грудной клетки). Метастазы в легкие и левую почку были без динамики. Было принято решение о смене таргетного препарата. С ноября 2011 г. начата терапия сорафенибом 800 мг/сут. Лечение больной переносил удовлетворительно в течение 4 месяцев.
Однако при контрольном осмотре в феврале 2012 г. выявлены метастазы в ткани передней стенки брюшной полости. Диагноз подтвержден ультразвуковым исследованием (УЗИ), выполнена тонкоигольная пункция этих очагов под контролем УЗИ (рис. 2). Гистологическое заключение № 3094-99: почечноклеточный рак. Лечение сорафенибом прервано.
По семейным обстоятельствам больной не явился на контрольный прием сразу после получения результатов пункции. При следующем обращении в мае 2012 г. выявлены умеренный рост очагов в мягких тканях передней стенки брюшной полости (по данным УЗИ) и увеличение внутригрудных лимфоузлов (по данным КТ органов грудной клетки).
Учитывая прогрессирование болезни после двух линий таргетной терапии, больному назначена терапия ингибитором mTOR (mammalian target of rapamycin – мишень рапамицина в клетках млекопитающих) эверолимусом 10 мг/сут с мая 2012 г. Лечение больной переносил удовлетворительно. Однако при очередном обследовании в сентябре 2012 г. выявлено прогрессирование заболевания: появление нового очага и увеличение ранее определяемых метастатических очагов в мягких тканях передней брюшной стенки и метастаза в единственную левую почку. Таким образом, терапия эверолимусом продолжалась около 4 месяцев и была прервана в связи с прогрессированием заболевания. Общее состояние больного оставалось удовлетворительным (оценка по ECOG – 0).
С учетом прогрессирования заболевания и удовлетворительного общего состояния больного решено продолжить таргетную терапию. Был выбран сунитиниб с учетом наиболее широкого спектра действия препарата на тирозинкиназы, а также на все известные рецепторы к факторам роста тромбоцитов (platelet-derived growth factor, PDGF) и эндотелия сосудов (vascular endothelial growth factor, VEGF), участвующие в процессе роста опухоли, патологическом ангиогенезе и метастазировании [2–4].
С сентября 2012 г. больной начал принимать сунитиниб в дозе 50 мг/сут. Лечение переносил удовлетворительно с умеренными проявлениями артериальной гипертонии.
При контрольном обследовании у больного в ноябре 2012 г. отмечена положительная динамика: уменьшились размеры очагов в мягких тканях и очага в единственной левой почке. КТ органов грудной клетки показало уменьшение внутригрудных лимфоузлов, что было расценено как частичный ответ. С учетом этих данных и хорошей переносимости препарата лечение продолжено в той же дозе.
При контрольном обследовании в январе 2013 г. выявлена стабилизация заболевания, решено продолжить терапию сунитинибом 50 мг/сут. В настоящее время больной продолжает прием сунитиниба 50 мг/сут с положительной динамикой и удовлетворительной переносимостью лечения в течение 14 месяцев.
Данный клинический пример подтверждает тот факт, что даже с учетом прогностических факторов предсказать ответ конкретного пациента на назначение препарата очень трудно. К счастью, арсенал таргетных препаратов в настоящее время позволяет достаточно эффективно лечить больных с метастатическим раком почки, добиваясь длительной стабилизации.
Заключение
Следует подчеркнуть, что каждый больной метастатическим раком почки нуждается в индивидуальном подходе, кроме того, необходимо тщательно контролировать ход лечения таргетными препаратами. Несмотря на наличие рекомендаций по использованию таргетной терапии у таких больных с учетом прогностических факторов, реальные клинические ситуации не всегда позволяют следовать стандартным рекомендациям. Решающее значение имеет опыт врача, проводящего таргетную терапию, и его взаимодействие со специалистами, осуществляющими обследование пациента в контрольные сроки при проведении терапии, при условии строгого соблюдения этих сроков обследования, что особенно актуально для отечественной клинической практики.