Причины
Причинами атонии мочевого пузыря являются такие факторы:
- недостаточное влияние нервной системы на сократительные мышечные волокна образования;
- травма крестцового отдела спинного мозга;
- аденома предстательной железы;
- дегенеративные заболевания позвоночника;
- повреждения задних корешков спинного мозга.
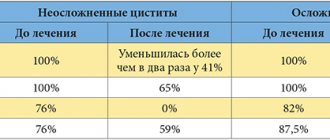
Атония мочевого пузыря у женщин встречается чаще, чем у мужчин. Иногда главная причина заболевания – частые циститы.
Лига нейрогенного мочевого пузыря
Лечение гипотонии мочевого пузыря
В соответствии с рекомендациями Европейской ассоциации урологов на сегодняшний день нет препаратов с доказанной эффективностью при гипотонии детрузора. Результаты проведенных исследований не позволяют говорить о целесообразности использования парасимпатомиметиков, особенно принимая во внимание частоту и/или выраженность возможных побочных эффектов.
При наличии в мочевом пузыре более 100-200 мл остаточной мочи должна выполняться периодическая катетеризация мочевого пузыря. Данный метод считается «золотым стандартом» ведения пациентов с нарушение опорожнения мочевого пузыря на фоне неврологических заболеваний.
Лечение детрузорно-сфинктерной диссинергии
Альфа-адреноблокаторы (как селективные, так и неселективные) продемонстрировали частичную эффективность в отношении уменьшения внутриуретрального сопротивления и остаточного объема мочи (уровень доказательности 2а).
К альфа-адреноблокаторам относят вещества, конкурентно ингибирующие альфа-адренорецепторы (альфа-АР). Имеется два основных подтипа альфа-АР. Это альфа1 и альфа2-АР. Альфа1-подтип расположен является мишенью консервативной терапии заболеваний мочевых путей. Идентифицированы три группы альфа1-АР: альфа1А, альфа1В и альфа1D. Альфа1А-АР доминируют в области шейки мочевого пузыря и проксимальной уретры, а альфа1D-АР в основном расположены в стенке мочевого пузыря и его куполе. Блокада альфа1А-подтипа вызывает снижение тонуса шейки мочевого пузыря и предстательной железы и улучшает отток мочи. Блокада альфа1D-АР-рецепторов приводит к уменьшению ирритативных симптомов.
С целью уменьшения явлений обструкции мочевого пузыря пациентам с нейрогенным мочевым пузырем могут быть назначены следующие альфа адреноблокаторы:
Тамсулозин — единственный селективный блокатор альфа1А-АР. Назначается один раз в сутки. Практически не влияет на артериальное давление, поэтому может приниматься с утра.
Альфузозин блокирует альфа1-АР преимущественно в мочеполовых органах, однако может значительно снижать артериальное давление. Рекомендуется использовать пролонгированные формы препарата.
Теразозин и доксазозин — селективные альфа1-адреноблокаторы пролонгированного действия. Назначаются 1 раз в сутки на ночь, так как вызывают артериальную гипотензию.
Миорелаксанты центрального действия
Миорелаксанты центрального действия благодаря релаксации поперечно-полосатой мускулатуры позволяют снизить тонус сфинктера уретры у пациентов с детрузорно-сфинктерной диссинергией.
Может быть назначен баклофен или тизанидин 3-4 раза в сутки.
В связи с выраженными побочными эффектами использование данной группы препаратов для коррекции расстройств мочеиспускания ограничено.
При неэффективности лекарственной терапии инъекции ботулинического токсина типа А в наружный сфинктер мочевого пузыря позволяют добиться его расслабления, облегчают мочеиспускания, уменьшают объем остаточной мочи.
Атрофический вагинит
Постменопаузный атрофический вагинит выявляется почти у 75% женщин спустя 5-10 лет после прекращения менструаций.
Состояние и функционирование многослойного плоского эпителия во влагалище зависит от эстрогенов. Когда женщина вступает в период менопаузы, в ее яичниках начинает вырабатываться все меньше эстрогенов, затем процесс выработки полностью останавливается. Это приводит к тому, что эпителий влагалища становится тонким, сухим (атрофируется), теряет эластичность и способность противостоять различным воспалениям.
У здоровой женщины репродуктивного возраста во влагалище поддерживается кислая среда (pH 3,5-5,5.), которая является препятствием для проникновения условно-патогенных и патогенных микроорганизмов.
Снижение выработки женских половых гормонов в яичниках приводит к тому, что из флоры влагалища начинают исчезать лактобактерии, производящие молочную кислоту, благодаря которой патогенные микроорганизмы не могут размножаться. Влагалищная среда становится щелочной, что приводит к снижению ее защитных свойств и появлению различных инфекций.
Наиболее частыми симптомами атрофического вагинита являются:
- сухость влагалища (урогенитальная атрофия);
- зуд и жжение во влагалище;
- мажущие кровянистые выделения из половых путей;
- опущение стенок влагалища;
- кольпит (воспаление слизистой оболочки влагалища, вызванное различными инфекциями);
- болезненные ощущения во влагалище при сексуальных контактах.
Также растяжение тазовых связок и ослабление тонуса мышц связок приводит к опущению органов, частым позывам к мочеиспусканию и недержанию мочи.
Диагностика атрофического вагинита
Диагностика урогенитальной атрофии достаточно простая и включает несколько обследований, таких как:
- гинекологический осмотр;
- расширенная кольпоскопия помогает увидеть толщину слизистой влагалища, имеется ли кровоточивость, состояние субэпителиальной сосудистой сети;
- лабораторные исследования (мазок на флору и бакпосев).
Виды урогенитальных расстройств
В XIX и начале XX вв. подобные проблемы были не актуальны, так как многие женщины просто не доживали до периода постменопаузы. В настоящее время урогенитальные расстройства наблюдаются у каждой третьей женщины, достигшей 55 лет и у семи женщин из десяти, достигших 70 лет.
Урогенитальный синдром (или урогенитальные расстройства, УГР) проявляется атрофическим вагинитом, уродинамическими и сексуальными нарушениями. Появление УГР напрямую связано с дефицитом эстрогенов, главных женских гормонов.
1 Урогенитальный синдром. Диагностика и лечение
2 Урогенитальный синдром. Диагностика и лечение
3 Урогенитальный синдром. Диагностика и лечение
Отсроченное первичное закрытие мочевого пузыря у детей с экстрофией и микроцистисом
Ю.Э. Рудин, Ю.Ю. Соколов, А.Ю. Рудин, Д.В. Марухненко, В.И. Руненко, А.С. Кирсанов, Е.В. Карцева, Н.В. Медведева
Сведения об авторах:
- Рудин Ю.Э. – д.м.н., профессор, руководитель группы детской урологии НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ«НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 423343
- Соколов Ю.Ю. – д.м.н., профессор, заведующий кафедрой детской хирургии ФГБУ РМАНПО Минздрава России; Москва, Россия; РИНЦ AuthorID 439748
- Рудин А.Ю. – врач детский уролог-андролог ГБУЗ ДГКБ св. Владимира ДЗМ; Москва, Россия;
- Марухненко Д.В .– к.м.н., заведующий детским уроандрологическим отделением НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 562464
- Руненко В.И. – к.м.н., заведующий детским уроандрологическим отделением ГБУЗ ДГКБ св. Владимира ДЗМ; Москва, Россия;
- Кирсанов А.С. – заведующий хирургическим отделением для новорожденных и недоношенных детей ГБУЗ ДГКБ св. Владимира ДЗМ; Москва, Россия; РИНЦ AuthorID 1047182
- Карцева Е.В. – к.м.н., детский хирург ГБУЗ ДГКБ св. Владимира ДЗМ; Москва, Россия; РИНЦ AuthorID 339435
- Медведева Н.В. – детский хирург ГБУЗ ДГКБ св. Владимира ДЗМ; Москва, Россия
ВВЕДЕНИЕ
Экстрофия мочевого пузыря (ЭМП) – один из самых тяжелых врожденных пороков развития, встречающихся в детской урологии. Тяжесть состояния в данном случае обусловлена большим объемом анатомического дефекта и сложностью его адекватной и функциональной коррекции [1-4].
К настоящему времени детскими урологами накоплен достаточной большой опыт лечения данного порока развития. Предложены различные варианты этапного [1-6] и одномоментного [7, 8-12] его оперативного лечения. Некоторые методики закрытия мочевого пузыря могут быть дополнены ортопедическими пособиями [1-6] с использованием особых вариантов иммобилизации в послеоперационном периоде [2, 13, 14] или выполняться без сведения костей таза [15, 16]. В лечении таких пациентов применяются новые фармакологические препараты, а также эндоскопическое введение объемообразующих веществ [4, 6]. Несмотря на это лечение экстрофии мочевого пузыря не всегда приводит к желаемому результату и по-прежнему остается сложной задачей [1-10].
ЭМП требует комплексного подхода для коррекции сложного сочетанного порока мочевыделительной и половой систем. Помимо отработанной хирургической техники, оснащенности клиники, подготовленности медицинского персонала и родителей, немаловажную роль играет взвешенный и тщательный отбор пациентов в зависимости от их исходных анатомических данных. Существует мнение, что малые размеры пузырной площадки – плохой прогностический признак для лечения экстрофии [1-8].
Операции первичного закрытия у новорожденных и младенцев с микроцистисом значительно чаще сопровождаются осложнениями и рецидивами [1-6, 13- 18]. Многие авторы рекомендуют иссечение пузыря у больных с микроцистисом и формирование резервуара из сегмента кишки уже в младенческом возрасте [1, 2, 4-6]. В связи с этим остаются дискуссионными вопросы, возможно ли растянуть пузырную площадку при ЭМП и попытаться сохранить функцию при микроцистисе? Целесообразно ли у пациентов с ЭМП c размером пузырной площадки менее 3 см, выполнение первичной пластики в периоде новорожденности или раннем младенческом возрасте? Какие сроки оптимальны для отсроченного первичного закрытия? В каких случаях стоит отказаться от попыток сохранения пузырной площадки в пользу аугментирующих операций?
МАТЕРИАЛЫ И МЕТОДЫ
За период с 1994 по 2021 год нами прооперировано 265 детей с экстрофией мочевого пузыря. В новорожденном возрасте от 2 суток до 30 дней в клинику госпитализированы 123 больных для первичного закрытия мочевого пузыря. Остальные 142 ребенка не были включены в данное исследование, так как они поступили в клинику в возрасте старше 1 года и были оперированы в возрасте от 12 мес. до 18 лет. Из них первичное либо вторичное закрытие требовалось 46 детям, остальным 96 детям (ранее оперированным в других клиниках) проведены различные этапы коррекции порока полового члена и недержания мочи.
Среди 123 новорожденных больных с ЭМП, подвергнутых анализу, мальчиков было 84 (68,2%), в два раза больше, чем девочек 39 (31,7%). Распределение больных в зависимости от формы порока было следующим: классическая экстрофия мочевого пузыря выявлена у 112 больных (91%), частичная экстрофия – у 8 (6,5%) детей, экстрофия клоаки – у 3 (2,4%) пациентов. Ранее оперативных вмешательств у всех этих детей не было. Для создания однородной группы больные с экстрофией клоаки и частичной экстрофией не были включены в исследование.
Все новорожденные больные с классической формой ЭМП (112 случаев) были разделены на две группы в зависимости от размеров пузырной площадки. В первую группу вошли 75 (67%) пациентов с большими и средними размерами пузырной площадки.
Большие (более 5 см) размеры мочевого пузыря имели 34 (30,3%) детей, средний размер экстрофированной площадки (31-50 мм) выявлен у 41 (36,6%) больных.
Вторую группу составили 37 (33%) детей с микроцистисом – малыми размерами пузырной площадки – 30 мм и менее (рис.1). Именно тактику лечения больных с микроцистисом мы решили разобрать в данной работе.
Рис. 1. ЭМП, микроцистис у мальчика возраста 1 месяц Fig. 1. Male newborn 1 month old with bladder exstrophy (BE), microcystis
Детям с микроцистисом была предложена различная тактика ведения, условно мы разделили больных этой группы на две подгруппы.
В первую подгруппу вошли 30 пациентов с микроцистисом, оперированные с 1994-2017 г., которым первичное закрытие мочевого пузыря провели в ближайшие после рождения сроки (3-15 дней), средний показатель 6,4 дня. (рис. 2).
Рис. 2. Распределение новорожденных больных с ЭМП и микроцистисом по возрасту в момент операции Fig. 2. Distribution of newborns with bladder exstrophy, microcystis by age according to moment of surgery
Объем операции у больных первой подгруппы составлял: выделение и закрытие мочевого пузыря, полное или частичное сведение лонного сочленения путем прошивания и стягивания костей таза, ушивание дефекта передней брюшной стенки. Пластику шейки мочевого пузыря и реимплантацию мочеточников изза малых размеров пузырной площадки не производили.
Во вторую подгруппу вошли 7 больных с микроцистисом, наблюдаемые в клинике в период с 2017- 2021 г., 5-му из которых было выполнено отсроченное первичное закрытие мочевого пузыря. Новорожденные дети были выписаны домой с рекомендациями по растяжению пузырной площадки мочевого пузыря
С целью увеличения размера пузырной площадки использовались методы механического растяжения стенки порочного мочевого пузыря посредством мануального давления – путем погружения пальца руки в резиновой перчатке во внутрь раскрытого эвентрированного мочевого пузыря на начальных этапах (рис. 3 А), а затем использовали раздувной баллон катетера Фолея. Методику погружения пальца и растяжения пузырной площадки катетером Фолей лечащий врач предварительно подробно объяснял и показывал родителям, контролировал правильность выполнения процедуры. Эффективность растяжения стенки пузыря оценивали на очных консультативных приемах, а чаще – дистанционно по фотографиям, высланным на электронный адрес врача.
Применение катетера Фолея для растяжения пузырной площадки с измерением объема вводимой в раздувной баллон жидкости в миллилитрах и определением уровня погружения баллона в формирующуюся полость, позволило более достоверно оценивать изменение размера пузырной площадки по глубине погружения, нежели измерение гибкой лентой или линейкой.
Принцип методики состоял в следующем: в баллон катетера Фолей 10-12 Сh вводился физиологический раствор, начиная с объема 3 мл – предположительная емкость мочевого пузыря. Пузырную площадку предварительно обрабатывали лубрицирующим анестетиком (например, гель Катеджель, Инстиллагель). Баллон катетера укладывали на место пузырной площадки и, постепенно надавливая на него сверху пальцами, погружали в полость малого таза, определяя тем самым более точно объем полусферы (рис. 3B)
Исходно объем пузырной площадки 5-6 мл (баллон катетера Фолея 10 мл погружался только наполовину) имели 6 детей, один ребенок имел объем 8 мл (баллон 10 мл – погружался в полость малого таза на 4/5).
По мере растяжения пузырной стенки объем вводимой жидкости и диаметр катетера увеличивали. После достижения глубокого погружения катетера с малым количеством физиологического раствора, объем баллона может быть еще увеличен для обеспечения дальнейшего растяжения. На баллон накладывали салфетку или турникет из нескольких салфеток и, в максимально погруженном состоянии, и фиксировали его к коже передней брюшной стенки лейкопластырем (рис. 3 C, D) с целью обеспечения более продолжительного механического воздействия. Время растяжения, постепенно увеличивали с 5 до 10, затем 20, 30 минут и более. После данной манипуляции пузырную площадку смазывали антибактериальной мазью (Левомеколь, Банеоцин). Данные процедуры проводили ежедневно с целью создания продолжительного по времени эффекта, имитирующего наполнение мочевого пузыря, для постепенного растяжения его стенки.
Рис. 3. Растяжение пузырной площадки у ребенка 6 месяцев с экстрофией и микроцистсом A – растяжение с помощью погружения пальца. B – установка баллона 5 мл. C, D – погружение и фиксация баллона лейкопластырем Fig. 3. Bladders plate tension in 6 months old newborn with bladder exstrophy and microcystis. A – tension by finger. B – tension using Foley’s сatheter balloon 5 ml. C, D – immersion and fixation of the balloon with an adhesive plaster
Для усиления результата мануального растяжения стенки мочевого пузыря мы использовали инъекции препарата Ботулотоксина типа А (БТА, BOTOX, лантокс). Обкалывание мышечной стенки пузырной площадки позволяет снять избыточный тонус, а в совокупности с механическим растяжением помогает добиться большего роста и растяжения стенки мочевого пузыря (МП) в меньшие сроки. В связи с особенностями фармакологических свойств действующего вещества, наиболее эффективным является двух-трехкратное обкалывание в 10-12 точках, не чаще 1 раза в 6 мес. В зависимости от возраста и веса ребенка мы применяли 50-100 Ед действующего вещества, разведенного на 4-8 мл физиологического раствора (рис. 4). Использование БТА осуществлялось на базе детского уроандрологического отделения ДГКБ Святого Владимира ДЗМ после предварительного получения информированного согласия родителей пациентов и одобрения локальным этическим комитетом.
Рис. 4 Обкалывание стенки мочевого пузыря с полипозными разрастаниями Ботулиническим анатоксином типа А у ребенка 7 мес с экстрофией и микроцистисом. Fig. 4 Injections of Botulinum toxin type A in bladders plate with polyps. Male newborn 7 months old with bladder exstrophy, microcystis
Применение БТА и механического воздействия на стенки пузыря позволило нам достичь постепенного растяжения пузырной площадки до объемов (размеров), позволяющих выполнить операцию первичного закрытия МП по расширенному протоколу, представленному нами ранее [18]. Увеличение размера пузырной площадки до 6-7 см или погружения баллона катетера Фолей объемом 9-11 мл в полость малого таза мы считали показанием для выполнения отсроченной операции.
Хирургическое вмешательство по протоколу включало: выделение и закрытие мочевого пузыря, иссечение крупных полипов, реимплантацию мочеточников из области треугольника Льето в дно мочевого пузыря с антирефлюксной защитой по Cohen, пластику шейки мочевого пузыря по Kelly с мобилизацией кавернозных тел от лонных костей (у мальчиков), двустороннюю остеотомию подвздошных костей с фиксацией отломков спицами, сведение и фиксацию лонных костей рассасывающейся нитью, пластику передней брюшной стенки, формирование пупка.
Отсроченное закрытие мочевого пузыря было выполнено 5 детям из 7 пациентов второй подгруппы с микроцистисом. Операции в возрасте 12-16 месяцев выполнены трем детям. Обкалывание ботулинотоксином в этой группе пациентов выполнено дважды. Другим двум пациентам отсроченное закрытие удалось осуществить позднее, в возрасте 21 и 26 месяцев, соответственно. Растяжение стенки мочевого пузыря проходило у них слишком медленно и обкалывание препаратом ботулотоксина произведено три раза.
У двоих пациентов на данном этапе лечения не удалось растянуть площадку до размера 4-5 см. Ткани остаются плотными и ригидными, а полипозные разрастания заполняют большую часть площадки. В случае дальнейшего отсутствия положительной динамики, этим детям планируется аугментация мочевого пузыря с формированием мокрой стомы.
РЕЗУЛЬТАТЫ
Результаты первичного закрытия мочевого пузыря у больных с микроцистисом проследили в сроки от 6 мес. до 15 лет.
В первой подгруппе из 30 детей с микроцистисом, оперированных новорожденными, осложнения наблюдали у 13 (43,3%) пациентов. Рецидив экстрофии возник у 10 (33,3%) больных. Расхождение послеоперационной раны передней брюшной стенки наблюдали у 3 (10%) детей (табл. 1.).
Таблица 1. Результаты первичного закрытия мочевого пузыря у детей с экстрофией с микроцистисом Table 1. Results of primary closure surgery in children with bladder exstrophy and microcystis
| Характер осложнений Complications Группы больных Patients’ groups | Рецидив экстрофии Relaps of exstrophy | Расхождение послеоперационной раны Wound dehiscence | Несостоятельность шейки мочевого пузыря Failure of the bladder neck | Итого Total |
| 1 группа: Микроцистис < 3 cм Microcystis < 3 cm 30 больных, оперированных новорожденными 30 patients operated on newborns | 10 (33,3%) | 3 (10%) | – | 13 (43,3%) |
| 2 группа: Микроцистис < 3 cм Microcystis < 3 cm 5 больных (отсроченные операции в 1 год и позднее) 5 patients (defered operations in 1 year and later) | – | – | 1 (20%) | 1 (20%) |
| Всего: 35 Total: 35 | 10 (28,6%) | 3 (8,6%) | 1 (2,9%) | 14 (40%) |
Повторные операции вторичного закрытия мочевого пузыря с двусторонней остеотомией были успешны у всех детей. Однако при дальнейшем наблюдении у 24 детей сохранялось полное недержание мочи и минимальная емкость мочевого пузыря. Для достижения удержания мочи 13 больным потребовалось от 3 до 5 операций каждому, включая повторную пластику шейки мочевого пузыря, чтобы в результате добиться увеличения его объема до 150 мл и удержания мочи более 2 часов. Аугментация мочевого пузыря сегментом тонкой кишки с аппендиковезикостомой для катетеризации мочевого пузыря, выполнена 11 детям из этой подгруппы.
Во второй подгруппе из 7 больных 5 детям проведена отсроченная операция первичного закрытия после предварительной подготовки и растяжения пузырной площадки, осложнений в виде рецидива экстрофии не наблюдали. Свищ мочевого пузыря возник у 1 (20%) ребенка, который самостоятельно закрылся через 2 месяца после вмешательства. Частичная несостоятельность шейки мочевого пузыря диагностирована у 1 (20%) больного. У остальных детей отмечается удержание мочи до 20 мин, порционное мочеиспускание. У всех этих пациентов наблюдается медленный рост объема мочевого пузыря.
В качестве примера представляем клиническое наблюдение лечения девочки с классической экстрофией мочевого пузыря и микроцистисом. Ребенок поступил в клинику на 5-е сутки после рождения. Учитывая малые размеры пузырной площадки менее 30 мм (рис. 5 А), решено отложить операцию и начать растяжение стенки мочевого пузыря. В возрасте 6 мес. проведено обкалывание стенки пузыря в 12 точках ботулиническим анатоксином типа А 100 Ед и на фоне механического растяжения мочевого пузыря и ботулинотерапии удалось увеличить размер мочевого пузыря (в полость малого таза удавалось погрузить баллон катетера Фолея объемом 10 мл). Размер пузырной площадки увеличился до 50 мм (рис. 5 B).
Рис. 5. А. — девочка 5 дней с классической экстрофией, микроцистисом, размер площадки 28 мм. B. — тот же ребенок в возрасте 8 мес. после проведения комплекса мероприятий по растяжению стенки пузыря. Fig. 5. A — female newborn 5 days old with bladder exstrophy, microcystis; the size of bladders plate – 28 mm. B – The same child at the age of 8 months after tension
В возрасте 1,5 лет проведена операция первичного закрытия мочевого пузыря с двусторонней ремплантацией мочеточников с антирефлюксной защитой по Коэну, пластикой шейки мочевого пузыря, двусторонней подвздошной остеотомией костей таза по Хиари с фиксацией отломков спицами, сведением лонных костей (викрил 2), пластикой передней брюшной стенки (рис. 6 A-D)
Рис. 6. Девочка 1,5 лет с классической экстрофией мочевого пузыря и микроцистисом при рождении. А. — вид площадки перед операцией после проведения комплекса мероприятий по растяжению мочевого пузыря. C. – этап операции первичного закрытия мочевого пузыря; мочеточники перемещены в дно мочевого пузыря, сформирована шейка мочевого пузыря. D. — результат первичного закрытия мочевого пузыря и двусторонней остеотомии. Fig. 6. Female 1,5 y.o. with bladder exstrophy, microcystis, A, B – bladder’s plate after tension, before surgery. C – surgery stage view; ureter replaced to the bottom of bladder, bladders neck formed. D – view after primary bladder’s closure and bilateral supra-acetabular osteotomy
Кости таза иммобилизованы дополнительно кокситной гипсовой повязкой. Послеоперационный период протекал гладко. Ребенок выписан домой на 14-е сутки. Кокситная гипсовая повязка снята на 45-е сутки. Спицы Киршнера удалены на 50-е сутки после операции. Ребенок мочится порциями по 25 мл. Сухие промежутки 15-20 минут.
ОБСУЖДЕНИЕ
Существуют различные мнения по срокам выполнения первичного закрытия мочевого пузыря. Часть авторов рекомендует проведение операции в первые дни или недели после рождения. Основной аргумент обоснования столь ранних операций – возможность полного сведения лонных костей без проведения подвздошной остеотомии и предупреждение воспалительных изменений и развития полипозных разрастаний на слизистой мочевого пузыря [1-3, 5-7, 11-14]. Другие авторы настаивают на возможности выполнения этих операций в возрасте 2-4 мес. и позднее [4, 5, 10, 15, 16]
Известно, что дети с экстрофией мочевого пузыря, которым не проводилось его первичное закрытие в течение первого года жизни, а нередко и значительно более длительный период жизни, не имели снижения функции почек, нарушения проходимости мочеточников, каких-либо грубых полипозных разрастаний и необратимых воспалительных изменений слизистой оболочки мочевого пузыря и уретры при правильном уходе за слизистой. Отсутствовали приобретенные ортопедические отклонения со стороны тазобедренных суставов, нарушения походки и естественного роста позвоночника [1-3, 5, 7]. Данные наших обследований подтвердили эти представления. Нарушения функции почек и расширения коллекторной системы не выявлено. Необратимых изменений слизистой мочевого пузыря у детей с первичной или вторичной экстрофией оперированных в возрасте 1-2-3-х лет и старше (мальчик 12 лет), мы не наблюдали.
Важным прогностическим фактором считают не только размер пузырной площадки, но и способность стенки мочевого пузыря к растяжению (ее эластичность) [1-3, 5, 6, 14-16]. Необходимо учитывать и особенности слизистой оболочки, наличие на ее поверхности грануляций, плотных, крупных полипозных разрастаний [14-16, 18-22]. При больших размерах мочевого пузыря единичные полипозные разрастания на отдельных участках слизистой не имеют практического значения и могут быть иссечены. У детей с микроцистисом в три сантиметра, разрастания на площади 2 см² превращают всю функциональную поверхность пузырной площадки мочевого пузыря в плотную, ригидную ткань не способную ни к растяжению, ни к сокращению.
У большинства новорожденных слизистая мочевого пузыря при рождении не имеет полипозных разрастаний и грануляций, эти воспалительные изменения могут возникнуть при неверном уходе за слизистой оболочкой. Прикладывание марлевых салфеток с антисептиками (хлоргексидин, мирамистин и др.) способствуют возникновению изменений на слизистой – она становится плотной, теряет эластичность и способность растягиваться. Поверхность пузырной площадки целесообразно укрывать тонкой (пищевой) пленкой из полиэтилена с точечными отверстиями в центре. Данный метод позволяет сохранять поверхность мочевого пузыря от травматических воздействий подгузника и одежды на продолжительный срок (до 10-15 мес. и более), препятствует возникновению воспаления [18, 20, 22]. Дети с экстрофией могут принимать ванну и душ, вести обычный образ жизни. Опрелости на коже, часто возникающие вокруг мочевого пузыря связаны не с воздействием мочи, а обусловлены грибковыми поражениями. Применение противогрибковых мазей (клотримазол, микосептин, миконорм) и регулярная замена подгузников, позволяют устранить гиперемию, эрозии и другие раздражения на коже.
Высокий риск послеоперационных осложнений, недержание мочи у всех пациентов с микроцистисом и проблемы плохого роста (увеличения объема) мочевого пузыря в дальнейшем, сложности выполнения эффективной пластики шейки мочевого пузыря, повышенное число повторных операций заставили нас отказаться от первичного закрытия мочевого пузыря в новорожденном возрасте у детей с размером пузырной площадки 3,0 см и менее. При наличии выраженных полипозных разрастаний и грануляций, в сочетании с отсутствием эластичности тканей мочевого пузыря, считаем более предпочтительным отсроченное лечение в возрасте 6-18 мес. или позднее, при условии достижения эффекта растяжения и увеличения размера пузырной площадки [18, 21-23].
Если пузырная площадка не поддается растяжению, мы рассматривали методики коррекции экстрофии с использованием аугментирующей пластики сегментом кишки [1-4, 22, 23]. Отсроченное первичное закрытие мочевого пузыря при экстрофии выполняют достаточно часто по разным причинам и в различные сроки [1-4, 11-13, 17, 21-23], но в доступной литературе мы не встретили описания методик постепенного растяжения пузырной площадки мочевого пузыря.
Сохранение собственного мочевого пузыря и возможность самостоятельного мочеиспускания с качественным удержанием мочи – чрезвычайно сложная проблема у больных с микроцистисом. Сложности возникают у этой группы больных и при формировании уретры c мобилизацией кавернозных тел полового члена из-за частого образования свищей уретры в области шейки [24]. Очень трудно создать шейку мочевого пузыря при отсутствии достаточного объема детрузора [25-29]. Некоторые хирурги решают просто эту задачу, используя кишечную пластику даже у детей младенческого возраста [1-4, 17, 30]. Возможно, снижение числа операций и сохранение психоэмоционального статуса ребенка важны, но не стоит забывать, что операции аугментации мочевого пузыря не столь безобидны и также сопровождаются целым рядом осложнений послеоперационного периода и могут требовать повторных хирургических вмешательств. Возможно рубцевание аппендикостомы, разрыв резервуара от переполнения, формирование камней в нем, при недостаточно качественном отмывании емкости от слизи и др. [1, 2, 4, 5, 8]. Мы полагаем, что формирование кишечного резервуара или аугментация мочевого пузыря более предпочтительны детям с экстрофией в более старшем возрасте, когда достижение качественного удержания мочи становится социально значимым для ребенка. В первые годы жизни больного важно попытаться сохранить собственный мочевой пузырь и возможность самостоятельного мочеиспускания, без участия взрослых в выполнении катетеризации для опорожнения пузырно-кишечного резервуара.
Наш опыт отсроченных операций позволяет определить возможности мочевого пузыря малых размеров к растяжению и росту, а методы механического воздействия на стенку пузыря в сочетании с обкалыванием пузыря ботулотоксином (БТА) позволяют ускорить этот процесс. Крайне сложно достичь растяжения уже закрытого мочевого пузыря малого объема без сформированной шейки. Требуется несколько лет и ряд сложных операций для получения заметного результата [1, 2, 5, 17, 22].
ВЫВОДЫ
Таким образом, отсроченное первичное закрытие мочевого пузыря у детей с микроцистисом после осуществления механического растяжения пузырной площадки в сочетании с обкалыванием стенки детрузора ботулиническим анатоксином типа А, позволяет улучшить результаты коррекции экстрофии в наиболее сложной группе больных с маленькими размерами пузырной площадки. В большинстве клинических наблюдений удалось добиться ускоренного роста пузырной площадки с перспективой формирования акта самостоятельного мочеиспускания и улучшения механизма удержания мочи.
ЛИТЕРАТУРА
- Purves JT, Gearhart JP. The bladder exstrophy-epispadias-cloacal exstrophy complex. In Pediatric Urology, 2-nd edition. . Elsevier Inc 2010. P. 386-415. https://doi.org/10.1016/B978-1-4160-3204- 5.00030-X.
- Gearhart JP, Jeffs RD. The bladder exstrophyepispadias complex. In Campbell’s Urology, 9th ed. , Philadelphia: W. B. Saunders; 2007: 560.
- Cuckow P. The bladder-exstrophy-epispadias-complex. Essentials of Pediatric Urology. Volume Chapter 15, 2-nd edition . London: Informa healthcare 2008. P.199-212.
- Меновщикова Л. Б., Рудин Ю. Э., Гарманова Т. Н., Шадеркина В. А. Клинические рекомендации по детской урологии-андрологии. М.: Издательство «Перо», 2015 г. с. 196-219. .
- Mushtaq I, Garriboli M, Smeulders N, Cheria A, Desai D., Eaton S, Cuckow P. Primary bladder exstrophy closure in neonates: challenging the traditions. J Urol 2014;191(1):193-7. https://doi.org/10.1016/j.juro.2013.07.020.
- Ренсли Ф., Барретини А. Стратегия и тактика ведения пациентов с экстрофией мочевого пузыря. Детская урология. Современные операционные методики: от внутриуробного периода до пубертата. Часть 3. Мочевой пузырь. [ред. М. Лима, Дж.Манцони; пер. с англ. под ред. С.Г.Врублевского]. М.: ГЭОТАР-Медиа, 2021, C.166-183. . Moscow: GEOTAR-Media, 2021. pp. 166-183 (In Russian)].
- Grady RW, Carr MC, Mitchell ME. Complete primary closure of bladder exstrophy. Epispadias and bladder exstrophy repair. Urol Clin North Am 1999;26(1):95-109. https:// doi.org/10.106/S0094-0143(99)80009-3.
- Pippi-Salle JL, Chan PT. One stage bladder exstrophy and epispadias repair in newborn male. The Can J Urol 1999;6(2):757–60.
- Kibar Y, Roth CC, Frimberger D, Kropp BP. Our initial experience with the technique of complete primary repair for bladder exstrophy. J Pediatr Urol, 2009;5(3):186-9. https://doi.org/10.1016/j.jpurol.2008.11.005.
- Leclair MD, Faraj S, Sultan S, Audry G, Héloury Y, Kelly JH, Ransley PG. One-stage combined delayed bladder closure with Kelly radical soft-tissue mobilization in bladder exstrophy: preliminary results. J Pediatr Urol 2018;14(6):558- 64. https://doi.org/10.1016/j.jpurol.2018.07.013.
- Gargollo PC, Borer JG, Diamond DA, Hendren WH, Rosoklija I, Grant R, Retik AB. Prospective followup in patients after complete primary repair of bladder exstrophy. J Urol 2008;180(4 Suppl):1665-70. https://doi.org/10.1016/j.juro.2008.05.076
- Suson KD, Preece J, Baradaran N, Di Carlo HN, Gearhart JP. The fate of the complete female epispadias and exstrophy bladder – is there a difference? J Urol 2013;190(4 Suppl):1583-89. https://doi.org/10.1016/j.juro.2013.01.093.
- Zaman M, Kasprenski M, Maruf M, Benz K, Jayman J, Friedlander D., et al. Impact of pelvic immobilization techniques on the outcomes of primary and secondary closures of classic bladder exstrophy. J Pediatr Urol 2019;15(4):382.e1-382.e8. https://doi.org/10.1016/j.jpurol.2019.04.009.
- Alam A, Blachman-Braun R, Delto JC, Moscardi PRM, Castellan M, Tidwell MA, et al. Bladder exstrophy closure in the newborn period with external pelvic fixation performed without osteotomy: a preliminary report. J Pediatr Urol 2018;14(1);32-e1-32,e7. https://doi.org/10.1016/j.jpurol.2017.08.012.
- Nikolaev VV. A less invasive technique for delayed bladder exstrophy closure without fascia closure and immobilisation: can the need for prolonged anaesthesia be avoided? Pediatr Surg Int 2019;35(11):1317–25. https://doi.org/10.1007/ s00383- 019-04530-0.
- Rösch WH, Promm M. Bladder exstrophy: quality of primary care and long-term prognosis. Urologe A 2016;55(1):53-7. https://doi.org/10.1007/s00120-015-0010-4. (In German).
- Oesterling JE, Jeffs RD. The importance of a successful initial bladder closure in the surgical management of classical bladder exstrophy: analysis of 144 patients treated at the Johns Hopkins Hospital between 1975 and 1985. J Urol 1987;137(2):258-62. https://doi.org/10.1016/S0022-5347(17)43972-3.
- Рудин Ю.Э., Соколов Ю.Ю., Рудин А.Ю., Кирсанов А.С., Карцева Е.В., Медведева Н.В. Объем операции при первичном закрытии мочевого пузыря у детей с экстрофией мочевого пузыря. Детская хирургия 2020;(1):21-28. .
- Рудин Ю. Э. Эписпадия и экстрофия мочевого пузыря. В: Урология. Национальное руководство [ред. Н.А. Лопаткин]. М.: «ГЕОТАР Медиа»;2009:273- 293. – Moscow: «GEOTAR media» Publisher house 2009:273-293. (In Russian)].
- Рудин Ю.Э., Марухненко Д.В., Чекериди Ю.Э., Руненко В.И. Первичная пластика мочевого пузыря при экстрофии у детей. Детская хирургия 2009;(4):26-31. .
- Baradaran N, Cervellione RM, Stec AA, Gearhart JP. Delayed primary repair of bladder exstrophy: ultimate effect on growth. J Urol 2012;188(6):2336-42. https://doi.org/10.1016/j.juro.2012.08.037.
- Di Carlo HN, Maruf M, Jayman J, Benz K, Kasprenski M, Gearhart JP. The inadequate bladder template: its effect on outcomes in classic bladder exstrophy. J Pediatr Urol 2018;14(5):427.e1-427.e7. https://doi.org/10.1016/j.jpurol.2018.03.023.
- Ahn JJ, Shnorhavorian M, Katz C, Goldin AB, Merguerian PA. Early versus delayed closure of bladder exstrophy: a National surgical quality improvement program pediatric analysis. J Pediatr Urol 2018;14(1):27.e1-27.e5. https://doi.org/10.1016/ j.jpurol.2017.11.008.
- Рудин Ю. Э., Марухненко Д. В., Алиев Д. К., Чекериди Ю. Э. Комплексное этапное лечение порока полового члена у мальчиков с эписпадией и экстрофией мочевого пузыря. Экспериментальная и клиническая урология 2016;(4):128-36. .
- Inouye BM, Lue K, Abdelwahab M, Di Carlo HN, Young EE, Tourchi A, et al. Newborn exstrophy closure without osteotomy: is there a role? J Pediatr Urol 2016;12(1):51.e1-4. https://doi.org/10.1016/j.jpurol.2015.07.010.
- Novak TE. Failed exstrophy closure. Semin Pediatr Surg 2011;20(2):97-101. https://doi.org/10.1053/j.sempedsurg.2010.12.004.
- Frimberger D, Gearhart JP, Mathews R. Female exstrophy: failure of initial reconstruction and its implications for continence. J Urol 2003;170(6):2428-31. https://doi.org/10.1097/01.ju.0000090195.72919.f5.
- Varma KK, Mammen A, Venkatesh SKK. Mobilization of pelvic musculature and its effect on continence in classical bladder exstrophy: a single-center experience of 38 exstrophy repairs. J Pediatr Urol 2015;11(2):87.e1-5. https://doi.org/10.1016/j.jpurol.2014.11.023.
- Khemchandani SI. The long-term outcomes after staged repair of exstrophy-epispadias complex. J Indian Assoc Pediatr Surg 2016;21(4):158-163. https://doi.org/10.4103/0971-9261.186544.
- Осипов И. Б., Казачков С.А., Смирнова Л. П., Попова Е. Д. Выбор метода оперативного лечения экстрофии мочевого пузыря. Урология и нефрология 1996;(5):21-3. .
Тематики и теги
Детская урология
Журнал
Журнал «Экспериментальная и клиническая урология» Выпуск №4 за 2020 год
Комментарии
Для отправки комментариев необходимо войти или зарегистрироваться
Лечение урогенитальных расстройств
Если причина появления урогенитальных расстройств кроется в дефиците эстрогенных влияний, то необходимо подобрать адекватную эстрогенотерапию. Очень эффективным является применение местных форм эстриола в виде свечей, мазей и гелей. В отличие от других видов эстрогенов, эстриол «работает» в тканях мочеполовых путей всего 2-4 часа и не оказывает воздействия на миометрий и эндометрий. Согласно данным многочисленных исследований, эстрогензамещающая терапия с помощью вагинального введения препаратов, содержащих эстриол (например, «Овестин»), приводит к улучшению состояния слизистых уретры и влагалища, увеличению количества лактобактерий, снижению pH-среды влагалища и способствует устранению инфекции.
В тяжелых случаях может применяться хирургическое лечение с коррекцией недержания мочи и опущения органов малого таза.
Не позволяйте недугу снизить качество вашей жизни! Доверьте профилактику и диагностику урогенитальных расстройств профессионалам! В «МедикСити» к вашим услугам профессиональный опыт лучших врачей-гинекологов и других медицинских специалистов!
Профилактика
Для профилактики астонии мочевого пузыря следует принимать превентивные меры по отношению к заболеваниям, которые могут привести к первой проблеме. Для женщин, например, – это соблюдение правил личной гигиены, избегание переохлаждений и инфекционных заболеваний.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.