Альфа-блокаторы для лечения аденомы простаты
Использование альфа-блокаторов для лечения аденомы простаты
Пример
| Название действующего вещества | Название препарата |
| альфузоцин гидрохлорид | Уроксатрал |
| доксазоцин месилат | Кардура |
| силодоцин | Рапафло |
| тамсулосин гидрохлорид | Фломакс |
| теразоцин гидрохлорид | Гитрин |
Принцип действия
Альфа-блокаторы помогают лечить аденому простаты расслабляя ткани гладких мышц простаты и шейки мочевого пузыря. Что позволяет увеличить ток мочи из мочевого пузыря.
Как правило препарат принимается перорально 1-2 раза в день.
В каких случаях используются данные препараты
Препарат используется пациентами со средними симптомами, которые доставляют беспокойство и которым не помогает лечение в домашних условиях для уменьшения симптомов увеличенной простаты.
Насколько хорошо помогают препараты
В большинстве случаев применения ингибиторов 5-альфа-редуктазы отмечается снижение индекса симптомов Американской Ассоциации урологии (ААУ) на 4-6 пунктов. Такое снижение дает ощущение значительного облегчения симптомов. Значительно улучшение симптомов наблюдается через 2-3 недели.
Использование комбинации альфа-блокаторов с ингибиторами 5-альфа-редуктазы дает больший эффект, чем их одиночное использование.
Побочные эффекты
Побочные эффекты различаются в зависимости от препарата и пациента. Общие незначительные побочные эффекты включают:
- Слабость или усталость.
- Головокружение или обморочное состояние при резком вставании из положения сиди или лежа. Это случается из-за того, что при резком вставании падает кровяное давление (постурологическая или ортостатическая гипотензия).
- Головная боль или заложенность носа.
Употребление медикаментов для лечения проблем с эрекцией, таких как силденафил (Виагра), варденафил (Левитра) или тадалафил (Циализ) могут усилить данные побочные эффекты.
Альфа-блокаторы могут вызвать эякуляцию спермы в мочевой пузырь, а не наружу через пенис. Это не опасно.
Побочные эффекты проходят с прекращением приема препарата.
Для ознакомления с полным списком побочных эффектов смотрите ссылку, посвященную Медикаментам.
О чем следует задуматься
Существуют свидетельства, что альфа-блокаторы более эффективны в уменьшении симптомов, чем финастерид.
Виды препаратов пролонгированного действия могут приниматься один раз в день, что делает их более удобными по сравнению с принятием финастерида.
Некоторые побочные эффекты, такие как низкое кровяное давление при резком вставании, могут случаться при их приеме в вечернее время.
В некоторых случаях альфа-блокаторы также используются для лечения высокого кровяного давления. Но некоторым пациентам альфа-блокаторы не помогают при высоком кровяном давлении или не подходят по другим причинам. Таким образом, в случае, если Вы принимаете альфа-блокаторы для лечения симптомов аденомы простаты, Вам следует принимать другие лекарства для снижения высокого кровяного давления.
По данным международного общества по изучению расстройств мочеиспускания (ICS), доброкачественная гиперплазия предстательной железы (ДГПЖ) наблюдается в среднем у 80% мужчин старше 60 лет. Ведущим в консервативном лечении ДГПЖ, по-прежнему остается медикаментозная терапия [1]. На сегодняшний день в лечении симптомов нижних мочевых путей (СНМП), обусловленных ДГПЖ, наиболее широко используются альфа1-адреноблокаторы, ингибиторы 5-альфа-редуктазы, препараты растительного происхождения и М-холиноблокаторы. Стандарты медикаментозной терапии ДГПЖ были приняты на основе результатов крупномасштабных рандомизированных двойных слепых плацебо-контролируемых клинических исследований. Наиболее эффективными препаратами зарекомендовали себя α-адреноблокаторы, их широкое использование позволяет отсрочить, а в ряде наблюдений и предотвратить оперативное лечение ДГПЖ [2].
Принято считать, что клиническая эффективность всех α1-адреноблокаторов в отношении СНМП примерно сопоставима, а выбор того или иного препарата в рутинной практике зачастую зависит от предпочтения пациента [3, 4, 5, 6]. Критериями выбора пациентами того или иного препарата могут являться: удобство применения, экономическая эффективность и выраженность побочных эффектов. При этом выбор конкретного препарата зависит от предпочтения врача, а также от информированности пациента. Если говорить об эволюции α1-адреноблокаторов в целом, то приоритетным направлением является создание суперселективных препаратов пролонгированного действия с минимальным количеством возможных побочных эффектов. При этом улучшение качества жизни пациента – важный аспект лечения и основная цель [7, 8, 9, 10].
Оценка предпочтений пациентов, страдающих ДГПЖ, привлекает внимание исследователей недавно. В данном сравнительном исследовании участвовали пациенты, получавшие в течение определенного периода времени наиболее широко применяемый α1-адреноблокатор тамсулозин, и α1-адреноблокатор доксазозин, как наиболее долго применяемый препарат в РФ. Оценивались долговременные предпочтения участников (какой препарат пациент желал бы принимать после окончания исследования).
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены пациенты, обратившиеся в клинику урологии и хирургической андрологии Российской медицинской Академии последипломного образования на базе ГКБ им. С.П. Боткина в период с февраля 2012 года по декабрь 2012 года, не получавшие лечения ранее. У всех участников исследования имелись расстройства мочеиспускания, ассоциированные с ДГПЖ; средний балл по Международной системе суммарной оценки симптомов при заболеваниях предстательной железы (IPSS) был > 15, балл по шкале IPSS-QoL > 3.
Каждый пациент предоставил письменное информированное согласие на участие в исследовании.
Исследование являлось рандомизированным, перекрестным, сравнительным и открытым. Пациенты были рандомизированы в две группы:
- группа Т-Д (тамсулозин 0,4 мг один раз в день в течение 6 недель, затем доксазозин 2 мг один раз в день в течение 1-й недели, 4 мг один раз в день в течение 2-й 3-й недели, 6 мг в день – с 4-й по 6-ю неделю),
- группа Д-Т (доксазозин 2 мг один раз в день в течение 1 недели, 4 мг один раз в день 2-ю 3-ю недели, 6 мг в день с 4-й по 6 неделю, затем тамсулозин 0,4 мг – один раз в день в течение 6 недель).
Исследуемые группы сравнивались при помощи перекрестного метода. Период «вымывания» препарата отсутствовал, поскольку прерывание лечения было признано неблагоприятным для пациентов.
Критерии включения в исследование: мужчины в возрасте старше 50 лет с симптомами нарушения мочеиспускания, обусловленные ДГПЖ, диагноз подтвержден результатами пальцевого ректального исследования не менее чем за 6 месяцев; максимальная скорость мочеиспускания 6-12 мл/с; объем мочеиспускания не менее 125 мл; объем остаточной мочи при трансабдоминальном сканировании не более 200 мл; сумма баллов по шкале IPSS более 12; объем предстательной железы при ТРУЗИ более 30 см3.
Критериями оценки результатов лечения являлись: сумма баллов по IPSS и IPSS-QoL; максимальная (Qmax) и средняя скорости (Qmax и Qave) потока мочи; а также объем остаточной мочи после мочеиспускания (PVR). Перечисленные показатели оценивались исходно и через 6 и 12 недель. Отдельно были оценены результаты для двух возрастных подгрупп: пациенты >65 лет и ≤ 65 лет.
Для определения предпочтений в отношении исследуемых препаратов все пациенты по окончании срока наблюдения (12 недель) подвергались открытому опросу. Пациентам предлагалось ответить на вопрос: «Каким препаратом он бы хотел продолжить лечение?», а так же объяснить причины выбора.
РЕЗУЛЬТАТЫ
Всего в исследование было включено 34 пациента (по 17 человек в каждой группе). Средний возраст составил 67,3 ± 6,3 лет (от 50 до 81 года). Анализ эффективности проводился для всех пациентов из групп Т-Д и Д-Т, завершивших исследование (выбывших не было). Обе группы были сравнимы по исходным характеристикам (табл.1).
На фоне лечения в обеих группах наблюдалось статистически значимое улучшение исходных показателей к 6-й и 12-й неделям исследования (сумма баллов по IPSS, p0,05). Аналогичная картина наблюдалась к 12-й неделе после смены препарата в группах пациентов. Отмечалось незначительное улучшение уродинамических характеристик при переходе с доксазозина на тамсулозин, и некоторое их снижение в группе, перешедшей с тамсулозина на доксазозин. Однако, как и на рубеже 6 недель наблюдения, эти различия не были статистически достоверными.
Таблица 1. Исходные характеристики больных ДГПЖ, имеющих СНМП
| ПОКАЗАТЕЛЬ | Группа Т-Д | Группа Д-Т | Статистическая значимость |
| Возраст (лет) | 67,4 + 6,2 | 67,3 + 6,1 | NS |
| IPSS | |||
| Сумма баллов по шкале IPSS | 18,1 ± 5,2 | 17,4 ± 5,9 | NS |
| Сумма баллов обструктивные симптомы | 7,1 ± 4,1 | 6,9 ±3,1 | NS |
| Сумма баллов ирритативные симптомы | 8,2 ± 2,5 | 7,6 ± 3,7 | NS |
| Сумма баллов по шкале QoL | 4,1 ± 1,0 | 3,9 ± 0,7 | NS |
| Qmax(мл/с) | 9,2 ±5,1 | 8,9 ±5,3 | NS |
| Qave(мл/с) | 4,2 ± 2,1 | 4,1 ±2,3 | NS |
| Объем остаточной мочи (мл) | 39,7 ± 31,8 | 41,1 ±40,2 | NS |
| Объем предстательной железы (см3) | 43,1 ± 13,0 | 39,1 ± 14,3 | NS |
Данные представлены в виде «среднее ± стандартное отклонение» NS-отсутствие статистически значимых различий (р
Таблица 2. Изменение основных уродинамических характеристик у больных ДГПЖ, имеющих СНМП, при приеме тамсулозина и доксазазина
| Группа Т-Д | Группа Д-Т | ||
| Сумма баллов IPSS p< 0,01 | До лечения | 18,1 ± 5,2 | 17,4 ± 5,9 |
| 6-я неделя | 13,7 ± 4,3 | 13,9 ± 4,7 | |
| 12-я неделя | 13,9 ± 5,0 | 13,8 ± 4,2 | |
| Сумма баллов IPSS обструктивная симптоматика p< 0,05 | До лечения | 7,1 ± 4,1 | 6,9 ± 3,1 |
| 6-я неделя | 5,8 ± 2,6 | 5,7 ± 3,4 | |
| 12-я неделя | 5,6 ± 3,1 | 5,7 ± 3,2 | |
| Сумма баллов IPSS ирритативная симптоматика p< 0,05 | До лечения | 8,2 ± 2,5 | 7,6 ± 3,7 |
| 6-я неделя | 6,0 ± 4,2 | 5,9 ± 3,9 | |
| 12-я неделя | 5,8 ± 3,2 | 5,9 ± 2,7 | |
| Сумма баллов по шкале Qol p < 0,05 | До лечения | 4,1 ± 1,0 | 3,9 ± 0,7 |
| 6-я неделя | 3,0 ± 1,2 | 3,1 ± 0,9 | |
| 12-я неделя | 3,0 1,0 | 3,0 1,1 | |
| Количество остаточной мочи (мл) p< 0,05 | До лечения | 39,7 ± 31,8 | 41,1 ± 40,2 |
| 6-я неделя | 16,7 ± 22,1 | 18,2 ± 21,5 | |
| 12-я неделя | 13,4 ± 14,3 | 16,1 ± 22,1 | |
| Максимальная скорость потока мочи (Qmax) P< 0,01 | До лечения | 9,2 ±5,1 | 8,9 ±5,3 |
| 6-я неделя | 14,8 ± 3,4 | 14,2 ±4,1 | |
| 12-я неделя | 15,1 ±3,9 | 14,8 ±3,6 | |
Показатели количества остаточной мочи к 6-й и 12-й неделям достоверно улучшались в обеих группах по сравнению с исходным уровнем (p
Нежелательные реакции, зарегистрированные во время проведения исследования, перечислены в табл. 3. Как было сказано выше, встречавшиеся нежелательные реакции не повлекли за собой отказ от приема препаратов и все пациенты закончили программу наблюдения. Общая частота нежелательных реакций во время приема тамсулозина была несколько ниже, чем во время приема доксазозина(23,5% и 32,4%, соответственно; p
Таблица 3. Нежелательные реакции у больных ДГПЖ, имеющих СНМП, при приеме тамсулозина и доксазазина
| Нежелательная реакция | Тамсулозин n (%) | Доксазозин n (%) |
| Ретроградная эякуляция | 5 (14,7) | 0 |
| Диарея | 0 | 0 |
| Заложенность носа | 0 | 1 (2,9) |
| Головокружение | 1 (2,9) | 4 (11,8) |
| Затрудненное мочеиспускание | 0 | 0 |
| Учащенное мочеиспускание | 0 | 0 |
| Эректильная дисфункция | 2 (5,8) | 0 |
| Сонливость | 0 | 3 (8,8) |
| Крапивница | 0 | 1 (2,9) |
| Сухость во рту | 0 | 2 (5,8) |
| Всего | 8 (23,5) | 11 (32,4) |
АНАЛИЗ ПО ВОЗРАСТНЫМ ПОДГРУППАМ
Отдельно были оценены результаты эффективности и безопасности препаратов для двух возрастных подгрупп: ≤ 65лет (n = 18) и > 65 лет (n=16).
Динамика уродинамических характеристик, количество остаточной мочи, снижение баллов по опросникам IPSS и Qol в обеих группах достоверно не отличались между собой. В обеих возрастных подгруппах, вне зависимости от порядка приема препаратов (Т-Д или Д-Т) к 6-й неделе достоверно улучшались следующие показатели: суммарный балл по IPSS (p
Частота нежелательных реакций у больных ≤ 65 лет была ниже, чем в старшей возрастной группе – 7 против 12. Однако все 7 случаев нежелательных реакций у молодых пациентов были связаны с расстройствами сексуальной функции и наблюдались на фоне приема тамсулозина. Остальные 12 эпизодов побочных реакций, приведенные в табл. 3, были отмечены в старшей возрастной группе.
По окончании 12 недель наблюдения пациенты ответили на вопрос: «Каким препаратом Вы бы хотели продолжить лечение?». Большинство пациентов – 20 (58,8%) выбрали тамсулозин, а в пользу доксазозина высказалось 13 (38,3%), один пациент отказался использовать в дальнейшем оба препарата. Причины, по которым пациенты предпочли тот или иной препарат отражены в табл. 4.
Все 13 пациентов отдавших предпочтение доксазозину были мужчинами из возрастной подгруппы ≤ 65 лет.
Несмотря на разные критерии выбора, побудившие пациентов отдать предпочтение одному из двух препара-тов, главным общим критерием являлось качество жизни, подразумевающее не только эффективность препарата в отношении симптомов нижних мочевых путей, но минимизацию возможных нежелательных реакций препарата. Для молодых, сексуально активных пациентов, отсутствие негативного влияния на сексуальную функцию стало определяющим критерием при выборе препарата доксазозин, хотя большинство из них субъективно отмечало несколько более высокую эффективность тамсулозина в отношении лечения расстройств мочеиспускания. В старшей возрастной подгруппе главными критериями выбора препарата стали преимущества режима дозирования и отсутствие/небольшое количество побочных эффектов, при этом возможное негативное влияние на половую функцию имело минимальное значение. Критерий «высокая эффективность», независимо от возрастной группы, оказался ведущим у пациентов, не имевших в процессе наблюдения побочных эффектов от приема препаратов.
Таблица 4. Критерии выбора больным альфа-адреноблокатора для дальнейшего лечения
| Критерий выбора | Тамсулозин, n (%) | Доксазозин, n (%) | Ни один из указанных препаратов, n (%) |
| Затрудняюсь ответить | 1 (2,9) | 2 (5,8) | — |
| Эффективность | 10 (29,4) | 3 (8,8) | — |
| Отсутствие/небольшое количество побочных эффектов | 4 (11,8) | 8 (23,5) | — |
| Преимущество режима дозирования | 5 (14,7) | 0 | — |
| Всего | 20 (58,8) | 13 (38,3) | 1(2,9) |
ЗАКЛЮЧЕНИЕ
В заключение следует сказать, что, поскольку ДГПЖ оказывает влияние на качество жизни пациента, при подборе терапии необходимо учитывать как индивидуальные особенности больного, так и преимущества того или иного препарата. В настоящем исследовании продемонстрировано, что даже среди α1-адреноблокаторов, специально разработанных для лечения ДГПЖ, имеются выраженные различия в отношении предпочтений пациентов. Мы считаем, что выбор пациента определяется эффективностью препарата, нежелательными реакциями, а также простотой и удобством применения. Данные литературы и результаты, полученные в настоящем исследовании, демонстрируют некоторые различия между тамсулозином и доксазозином. Несмотря на небольшую выборку пациентов, можно говорить о сравнимой эффективности тамсулозина и доксазозина в отношении симптомов нижних мочевых путей при суммарно несколько меньшем количестве побочных эффектов на фоне приема тамсулозина. Однако характер нежелательных явлений, их огромное значение для качества жизни многих пациентов, позволяет делать выбор в пользу некоторых давно известных α1-адреноблокаторов, в частности доксазозина, без особой потери в эффективности лечения симптомов нижних мочевых путей.
ЛИТЕРАТУРА
- Holtgrewe HL. e medical management of lower urinary tract symptoms and benign prostatic hyperplasia. // UrolClin North Am. 1998. Vol. 25. P. 555 569.
- Montorsi F, Roehrborn C, Garcia-Penit J, Roeleveld TA, Alimi JC, Gagnier P, Wilson TH. The effects of dutasteride or tamsulosin alone and in combination on storage and voiding symptoms in men with lower urinary tract symptoms (LUTS) and benign prostatic hyperplasia (BPH): 4-year data from the Combination of Avodart and Tamsulosin (CombAT) study. // BJU Int. 2011. Vol. 107, N 9. P. 1426-1431.
- Nordling J. Efficacy and safety of two doses (10 and 15 mg) of alfuzosin or tamsulosin (0.4 mg) once daily for treating symptomatic benign prostatic hyperplasia 2005. // BJU. 1995. Vol. 95, N 7. P. 1006-10012.
- Kyprianou N, Litvak JP, Borkowski A, Alexander R, Jacobs SC. Induction of prostate apoptosis by doxazosin in benign prostatic hyperplasia. // J Urol. 1998. Vol. 159, N 6. P. 1810 -1815.
- Furuya S, Kumamoto Y, Yokoyama E, Tsukamoto T, Izumi T, Abiko Y. AlphaAdrenergic activity and urethral pressure in prostatic zone in benign prostatic hypertrophy. // J Urol. 1982. Vol. 128, N 4. P. 836-839.
- Лоран О.Б., Вишневский Е.Л., Вишневский А.Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты адреноблокаторами. М., 1998. 124 c.
- Lepor H. The evolution of alphа-blockers for the treatment of benign prostatic hyperplasia. // Rev Urol. 2006. Vol. 8, Suppl 4. P.3-9.
- Abrams P, Schulman CC, Vaage S, and the European Tamsulosin Study Group. Tamsulosin a selective alpha1-adrenoreceptor antagonist: a randomized, controlled trial in patients with benign prostatic «obstruction» (symptomatic BPH). // Br J Urol. 1995. Vol. 76. P. 325-336.
- Chapple CR, Wyndaele JJ, Nordling J, Boeminghaus F, Ypma AF, Abrams P. Tamsulosin, the first prostate-selective a alpha1-adrenoreceptor antagonist: a meta-analysis of two randomized, placebo-controlled multi-centre studies in patients with benign prostatic obstruction (symptomatic BPH). // Eur Urol. 1996. Vol. 29, N 2. P. 155-167.
- Narayan P, Tewari A, and the Members of United States 93-01 Study Group. A second phase III multi-centre placebo-controlled study of 2 dosages of modified release tamsulosin in patients with of benign prostatic hyperplasia. // J Urol.1998. Vol. 160. P. 17011706.
| Прикрепленный файл | Размер |
| 150.69 кб |
‹ Первый опыт эндоскопической экстраперитонеальной радикальной простатэктомии после трансуретральной энуклеации предстательной железы Вверх Прогностическое значение эозинофилов и лимфоцитов крови при лечении инфекционно-воспалительных заболеваний в урологии ›
Альфа-адреноблокаторы в урологии
К альфа-адреноблокаторам (альфа-АБ) относят вещества, конкурентно ингибирующие альфа-адренорецепторы (альфа-АР) фентоламин, троподифен, гидрированные производные алкалоидов спорыньи и другие вещества. Действие альфа-АБ не совпадает полностью с блокадой нервных импульсов, поступающих по постганглионарным симпатическим волокнам, так как эти вещества блокируют главным образом стимулирующие эффекты, связанные с возбуждением альфа-АР (сужение сосудов, сокращение мышцы радужной оболочки глаза и т. п.). Тормозящие же эффекты (например, расслабление гладкой мускулатуры бронхов и кишечника) сохраняются. Альфа-адренорецепторы равномерно распределены в организме человека. Имеется два основных подтипа альфа-АР. Это альфа1 и альфа2-АР. Подтип альфа2 расположен пресинаптически и вызывает снижение выработки норэпинефрина через отрицательный механизм обратной связи. Альфа1-подтип расположен постсинаптически и является мишенью консервативной терапии заболеваний мочевых путей, в большей степени доброкачественной гиперплазии предстательной железы (ДГПЖ). Применение неселективных альфа-АБ (воздействующих на альфа1 и альфа2-АР) ограничено в связи с тем, что эти препараты блокируют как пре-, так и постсинаптические альфа-АР. Следует учитывать, что блок пресинаптических альфа-АР нарушает физиологическую авторегуляцию выделения медиатора норадреналина. В результате нарушения отрицательной обратной связи происходит избыточное высвобождение норадреналина, способствующее восстановлению адренергической передачи. Последнее объясняет недостаточную стойкость блока постсинаптических рецепторов альфа1-АР при использовании неселективных альфа-АБ. Повышенная тахикардия является результатом повышенного высвобождения норадреналина. Благодаря функционирующим альфа2-АР сохраняется механизм отрицательной обратной связи, и, следовательно, повышенного выделения норадреналина не происходит. При этом блок постсинаптических альфа1-АР становится более стабильным. Кроме того, не возникает выраженной тахикардии. С учетом данных особенностей были разработаны препараты, оказывающие избирательное блокирующее действие на постсинаптические (периферические) альфа1-АР, например, празозин.
Основываясь на молекулярных характеристиках различной связывающей способности и клонирования специфической последовательности ДНК, были идентифицированы три группы альфа1-АР: альфа1А, альфа1В и альфа1D [2]. Альфа1А-АР доминируют в гладкомышечных клетках ПЖ и шейки мочевого пузыря, а альфа1D-АР в основном расположены в стенке мочевого пузыря и его куполе (рис. 1). В связи с чем блокада альфа1А-подтипа вызывает снижение тонуса ПЖ и тем самым улучшает динамический компонент инфравезикальной обструкции. Детрузорная нестабильность проявляется через стимуляцию альфа1D-АР-рецепторов, а блокада их в эксперименте над животными показала снижение ирритативных симптомов. В свою очередь альфа1D-АР также обнаруживаются в спинном мозге, где они играют предположительную роль в симпатической модуляции парасимпатической активности. Альфа1В-АР расположены главным образом в миоцитах артерий и вен, в том числе и в микроциркуляторном русле предстательной железы. Их блокада вызывает такие симптомы, как головокружение и гипотензию, так как приводит к снижению периферического сопротивления через вено- и артериодилятацию. Как уже было подтверждено многочисленными исследованиями, альфа1А- и альфа1D-АР выявляются и в стенке дистальных отделов мочеточника, что также делает обоснованным применение альфа1-АБ в литокинетической терапии конкрементов мочеточника. На рис. 2 показано распределение альфа1-АР согласно их встречаемости в мочеполовой, сердечно-сосудистой и ЦНС.
Терапия альфа1-АБ в целом переносится хорошо, нежелательные эффекты относительно редки. По данным ведущих исследователей, чаще всего встречается ортостатическая гипотензия, головокружение, общая слабость и нарушения эякуляции. Внутри фармакологической группы альфа1-АБ различаются по степени выраженности и длительности альфа1А-, альфа1В- и альфа1D-рецептор-блокирующего действия (). Применение альфа-АБ сопряжено с нормализацией уродинамики, снижением выраженности ирритативных симптомов, улучшением качества жизни, а также предотвращением прогрессии заболевания (в частности, острой задержки мочи и необходимости оперативного лечения). В
и
представлены обобщенные данные разных исследователей по эффективности наиболее часто применяемых альфа1-АБ, доксазозина и тамсулозина.
При лечении ДГПЖ альфа1-АБ являются препаратами первой линии терапии. Они используются как в монотерапии, так и в комбинации с ингибиторами 5-альфа редуктазы (5АРИ). В одном из фундаментальных исследований последнего десятилетия — MTOPS было показано наибольшее преимущество от комбинированного применения финастерида и доксазозина в лечении симптомов нижних мочевых путей и увеличении максимальной скорости мочеиспускания, чем этих препаратов по отдельности. В нем было продемонстрировано, что применение комбинированной схемы лечения препаратами группы альфа1-АБ и 5АРИ не приводит к увеличению числа нежелательных явлений. По нашим собственным данным комбинированное применение доксазозина и финастерида в течение 6 месяцев терапии приводит к статистически значимому снижению как обструктивных, так и ирритативных симптомов нижних мочевых путей (СНМП), описываемых шкалой I-PSS. Значительно улучшается максимальная скорость мочеиспускания, качество жизни пациентов. Средний объем ПЖ к концу указанного срока снизился на 18%.
Альфа-АБ отводится немаловажная роль в лечении впервые возникшей острой задержки мочеиспускания. Наибольший эффект от терапии наблюдается при сочетании альфа-АБ и дренирования мочевого пузыря уретральным катетером в течение нескольких суток. Опыт применения доксазозина и тамсулозина у 273 пациентов в возрасте от 52 до 74 лет в предоперационной подготовке указывает на то, что включение альфа-АБ в схему предоперационной подготовки может предупредить развитие послеоперационной острой задержки мочи.
Не меньшее значение отводится использованию альфа-АБ в лечении хронического простатита (ХП) и хронического синдрома тазовой боли (ХСТБ). По данным различных авторов признаки ХП выявляются у каждого 10-го мужчины. Большинство из них на протяжении жизни имеют несколько случаев обострения ХП, а также проявления ХСТБ. Фармакологическая стратегия включает эмпирическую антибактериальную терапию, несмотря на то, что до 90% всех случаев имеют абактериальную природу. Даже учитывая, что большинство урологов имеют дело с абактериальным простатитом, тем не менее более 50% этих пациентов получает антибактериальную терапию. Снижение тонуса предстательной железы и гладкой мускулатуры мочевого пузыря может улучшить скорость мочеиспускания и облегчить СНМП, что указывает на точку приложения альфа-АБ в лечении ХП и простатодинии. Последние исследования показывают, что добавление альфа-АБ к антибактериальной терапии может уменьшить риск рецидива хронического бактериального простатита (ХБП). Однако оптимальная длительность терапии альфа-АБ до сих пор не определена. Феноксибензамина гидрохлорид, являясь неселективным альфа-АБ, показал улучшение симптомов ХП, несмотря на значительные побочные эффекты. Другие исследования показывают, что 6-месячный курс альфа-АБ значительно снижает болевой синдром, связанный с ХП, по сравнению с плацебо и традиционной терапией, но не улучшает скорость мочеиспускания и качество жизни согласно опроснику I-PSS. Схожее исследование, сравнивающее различные альфа-АБ между собой, показало, что доксазозин по сравнению с плацебо более эффективен и вызывает значительное улучшение в виде уменьшения выраженности болей у данной группы пациентов. Дальнейшие исследования показывают, что альфа-АБ снимают болевой синдром и улучшают качество жизни у пациентов с хроническим простатитом. Говоря об особенностях различных селективных альфа-АБ, нужно отметить, что, обладая сравнимой с доксазозином эффективностью и безопасностью, тамсулозин является более удобным препаратом для пациентов в связи с отсутствием необходимости титрования дозы. Использование альфа1-АБ может снижать специфические симптомы у пациентов с ХБП и СХТБ, в случае назначения антибактериальной терапии и без нее. Практически все исследователи сходятся во мнении, что комбинация альфа1-АБ с антибактериальными препаратами не только может усилить эффект от терапии путем снижения болей и других симптомов, ассоциированных с ХП, но также может снизить риск рецидива ХП.
Другой, не менее важной областью применения АБ может стать лечение гиперактивного мочевого пузыря (ГАМП). На сегодняшний день в мире насчитывается до 100 миллионов человек, страдающих теми или иными проявлениями ГАМП. В. Г. Гомберг с соавт., наблюдая 30 пациенток, принимавших доксазозин в качестве монотерапии по поводу ГАМП, отмечают, что через 2 месяца приема препарата частота императивных позывов на мочеиспускание снизилась на 49%, а частота эпизодов ургентной инконтиненции — на 70%. Также авторами было отмечено увеличение емкости мочевого пузыря на 35%.
Как и активное применение альфа1-АБ в лечении ХП, начало XXI века ознаменовалось внедрением альфа1-АБ в схемы литокинетической терапии камней мочеточника, что поначалу встретило естественную критику. На сегодняшний день применение альфа1-АБ вполне оправдано у больных с мелкими конкрементами мочеточника, однако до сих пор некоторые специалисты ставят его под сомнение или просто говорят о том, что выигрыш от такой терапии не настолько высок, как его представляют. Losek R. L. и соавт., проанализировав поисковые системы PubMed и MEDLINE, обнаружили пять проспективных исследований, касавшихся использования тамсулозина в литокинетической терапии после однократного сеанса дистанционной ударно-волновой литотрипсии (ДУВЛ). В одном из них пациенты наблюдались в течение 12 недель после сеанса ДУВЛ. Как оказалось, отхождение фрагментов конкрементов наступило в 60% в контрольной группе по сравнению с 78,5% группы, принимавшей тамсулозин. Среди исследований, оценивавших полное отхождение конкрементов, доля их отхождения в контрольной группе составила 33,3–79,3% по сравнению с 66,6–96,6% в группе, принимавшей тамсулозин. В случае применения тамсулозина дозы анальгетиков также были ниже по сравнению с контрольной группой. К сожалению, в большинстве исследований не указывалось, в каком числе случаев в последующем выполнялись дополнительные сеансы ДУВЛ и уретероскопии. Авторы заключают, что назначение тамсулозина после сеанса ДУВЛ является безопасным и эффективным средством, улучшающим отхождение конкрементов почек от 10 до 24 мм. Другими исследователями, наблюдавшими 56 пациентов, перенесших ДУВЛ, было отмечено, что применение тамсулозина уменьшает количество назначаемых нестероидных анальгетиков в процессе лечения больных после ДУВЛ. Авторы полагают, что комплексное применение тамсулозина при электрофорезе с Новокаином у этой категории больных усиливает литокинетический эффект. В другом исследовании, оценивая эффективность тамсулозина в дозе 0,4 мг в литокинетической терапии мелких конкрементов мочеточника как с, так и без применения ДУВЛ, B. Kupeli показал, что в случае назначения альфа1-АБ у пациентов с мелкими конкрементами мочеточника (3–5 мм) отхождение конкрементов наступало чаще и составило 53,3% случаев по сравнению с контрольной группой — 20%. В случае выполнения сеанса ДУВЛ пациентам с конкрементами мочеточника более 5 мм (6–15 мм) в группе тамсулозина в 70,8% случаев наступало полное отхождение конкрементов по сравнению с контрольной группой — 33,3%. E. Yilmaz продемонстрировал сопоставимую эффективность применения теразозина, доксазозина и тамсулозина в литокинетической терапии дистальных конкрементов мочеточника. Несмотря на большое число данных, демонстрирующих преимущества литокинетической терапии в сочетании с альфа1-АБ, необходимы исследования, оценивающие различные дозы альфа-АБ и их способность уменьшения вероятности дополнительных сеансов ДУВЛ и таких инвазивных манипуляций, как уретероскопия.
Заключение
Подводя итог сказанному, можно заключить, что использование альфа-АБ оправдано при многих урологических состояниях, а блокада альфа1А-АР и альфа1D-АР предпочтительна при ДГПЖ и в схемах литокинетической терапии конкрементов мочеточника. Благодаря многочисленным международным исследованиям, а также появляющимся отечественным публикациям, показавшим безопасность и высокую эффективность альфа1-АБ, учитывая невысокую стоимость препаратов данной группы и их повсеместную доступность, в распоряжении уролога появился важный, высокоэффективный инструмент, позволяющий улучшить качество жизни пациентов с ДГПЖ и ХСТБ, снизить число рецидивов хронического простатита, а также уменьшить время нахождения в стационаре больных с мелкими конкрементами мочевых путей.
По вопросам литературы обращайтесь в редакцию.
А. Б. Богданов*, И. В. Лукьянов, кандидат медицинских наук, доцент Е. И. Велиев, доктор медицинских наук, профессор *ГКБ им. С. П. Боткина, РМАПО, Москва.
Медицинские интернет-конференции
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее часто встречающихся урологических заболеваний, особенно среди мужчин старшей возрастной группы. Признаки заболевания встречаются у 10-20% мужчин в возрасте 40 лет, а его удельный вес у мужчин старше 80 лет составляет 80–90% [1].
В настоящее время существует несколько вариантов ведения пациентов с ДГПЖ и обусловленными ей симптомами со стороны нижних мочевыводящих путей (СНМП): тактика наблюдения, медикаментозная терапия и различные оперативные методы лечения, среди которых сохраняют своё значение открытые и малоинвазивные, в том числе высокоэнергетические и эндоваскулярные [2]. В мировом урологическом сообществе постоянно обсуждаются и ежегодно корректируются показания к тому или иному методу, в том числе и к фармакотерапии. При планировании медикаментозной терапии необходимо определить срок проводимого лечения: пожизненный прием препаратов в качестве основного метода лечения заболевания или краткий курс с целью подготовки пациента к оперативному вмешательству.
Основные задачи фармакотерапии ДГПЖ:
· предотвратить прогрессирование заболевания — остановить рост предстательной железы;
· снизить выраженность клинической симптоматики и повысить качество жизни пациента — снизить гипертонус гладкомышечных волокон простаты и задней уретры, улучшить кровоснабжение мочевого пузыря, восстановить сократительную способность детрузора и качество мочеиспускания.
При выборе препарата для медикаментозной терапии ДГПЖ необходимо учитывать следующие факторы: соматическое состояние пациента, наличие показаний к оперативному лечению, отсутствие подозрения на рак предстательной железы, выраженность обструктивных и ирритативных симптомов, степень инфравезикальной обструкции и уродинамических нарушений, наличие осложнений ДГПЖ, выраженность сопутствующего воспалительного процесса в предстательной железе, уровень половой активности пациента. Также следует помнить о том, что выраженность морфологических признаков ДГПЖ (увеличение размеров простаты) далеко не всегда коррелирует с клиническими проявлениями.
Исходя из всего указанного выше, в настоящее время сформулированы следующие показания к проведению медикаментозной терапии ДГПЖ: суммарный балл IPSS > 8, но < 19, QOL менее 4 баллов, Qmax не более 15 и не менее 5 мл/с, объём остаточной мочи не более 150 мл, выраженная сопутствующая патология, отказ пациента от оперативного вмешательства. Особое значение в контроле эффективности консервативной терапии при ДГПЖ-ассоциированных обструктивных СНМП имеет динамическое измерение скорости потока мочи с помощью урофлоуметрии [3].
Противопоказаниями к медикаментозной терапии ДГПЖ являются: наличие «средней доли» предстательной железы по данным визуализирующих методов исследования, подозрение на рак предстательной железы, признаки выраженной инфравезикальной обструкции и большое количество остаточной мочи, нейрогенные нарушения, индивидуальная непереносимость препаратов [4].
Согласно Рекомендациям 4-го Согласительного комитета ВОЗ по гиперплазии предстательной железы (Париж, 2—5 июля 1997) основными препаратами для терапии ДГПЖ являются ингибиторы 5-α-редуктазы и α-адреноблокаторы. Тадалафил, ингибитор фосфодиэстеразы-5 с наибольшим периодом полувыведения, также одобрен в качестве средства терапии СНМП, но механизмы его фармакодинамики при ДГПЖ остаются во многом неясными и требуют дальнейшего изучения [5].
Ингибиторы 5-α-редуктазы
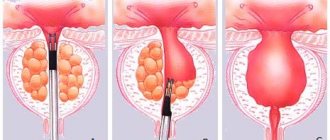
Препараты данной группы воздействуют непосредственно на патогенетические механизмы заболевания. Предстательная железа является гормонально-зависимым органом, находящимся под контролем гипоталамо-гипофизарно-гонадной системы. 5-α-редуктаза — фермент, который находится в ядрах стромальных клеток предстательной железы и отвечает за трансформацию тестостерона в дигидротестостерон (ДГТ). Последний представляет собой активную тканевую форму гормона и опосредует андрогенное действие на предстательную железу, стимулируя пролиферацию клеток и угнетая их апоптоз. К настоящему времени выявлено 3 изоэнзима 5-α-редуктазы: I типа, который характеризуется экстрапростатической локализацией (в основном представлен в печени и в коже); II типа, локализуется преимущественно в ткани предстательной железы и семенных пузырьков, а также коже скальпа; III типа, который экспрессируется повсеместно [6]. В норме в ткани органа определяются все три разновидности фермента, однако при ДГПЖ происходит их гиперэкспрессия, что обуславливает гиперплазию стромальных и эпителиальных клеток и нарушение их соотношения. В ряде работ показано, что при ДГПЖ происходит гиперэкспрессия преимущественно 5-α-редуктазы II типа, в отличие от рака простаты.
Таким образом, назначение ингибиторов 5-α-редуктазы является патогенетически обоснованным. Нарушая функцию фермента, препараты данной группы снижают концентрацию ДГТ, индуцируют атрофию и стимулируют апоптоз клеток, что, в конечном счете, приводит к уменьшению размеров органа и ликвидации механического компонента инфравезикальной обструкции [7].
Для клинического использования доступны 2 препарата данной группы – финастерид и дутастерид. Каждый из них обладает рядом фармакодинамических и фармакокинетических особенностей по отношению к другому. Так, финастерид блокирует только 5-α-редуктазу II и III типа, тогда как дутастерид – фермент всех трёх типов. Период полувыведения для финастерида составляет 6-8 часов, для дутастерида он выше и составляет 3-5 недель. Оба препарата метаболизируются в печени и выводятся с калом. Продолжительное лечение снижает уровень ДГТ плазмы через 6 месяцев после лечения на 70 % при применении финастерида и на 95 % — дутастерида. В то же время концентрация ДГТ в предстательной железе снижается до сходного уровня (80-95%) в случае использования обоих препаратов. Рекомендуемая суточная доза составляет 0,5 мг для дутастерида и 5 мг – для финастерида [6,7,8].
Эффект при приёме ингибиторов 5-α-редуктазы проявляется через 6-12 месяцев после приема препаратов и заключается в снижении объема предстательной железы в среднем на 18-28% и снижении уровня сывороточного ПСА приблизительно на 50%. Данный факт необходимо учитывать при определении показаний к биопсии предстательной железы. Существуют данные, что размеры предстательной железы могут в дальнейшем уменьшаться при долгосрочном лечении. После 2-4 лет лечения ингибиторы 5-α-редуктазы снижают исходный уровень по шкале IPSS на 15-30% и увеличивают Qmax по данным урофлоуметрии на 1.5-2.0 мл/сек [6].
Воздействие финастерида на клинические симптомы зависит от размера предстательной железы до лечения и не является доказанным у пациентов с размером простаты менее 40 мл. В то же время дутастерид, по данным ряда авторов, снижает IPSS и объем простаты и увеличивает Qmax. у пациентов с начальным объемом органа от 30 до 40 мл. Непрямые сравнения между различными исследованиями показали эквивалентную эффективность финастерида и дутастерида у пациентов с ДГПЖ. Сравнительные исследования с α–адреноблокаторами показали, что ингибиторы 5-α-редуктазы снижают выраженность клинической симптоматики медленнее. В то же время именно препараты данной группы, а не α-адреноблокаторы, снижают долгосрочный риск острой задержки мочеиспускания и необходимость хирургического вмешательства [6].
Наиболее значимые негативные эффекты ингибиторов 5-α-редуктазы связаны с сексуальной функцией и включают в себя: снижение либидо, эректильную дисфункцию, и, менее часто, снижение объёма эякулята. Данные явления развиваются у 6-8% пациентов. Как правило, побочные эффекты появляются на первом году лечения препаратами и в дальнейшем их выраженность не нарастает. В 1-2% случаев развивается гинекомастия [6].
Таким образом, множественные многоцентровые клинические исследования подтвердили эффективность данной группы препаратов. Данные большинства исследований не показывают значительных преимуществ в клинической эффективности одного из препаратов перед другим. [7] Однако назначение данных препаратов имеет ряд особенностей и должно осуществляться у определенной категории пациентов. Лечение ингибиторами 5-α-редуктазы должно применяться у пациентов с умеренно выраженными обструктивными и ирритативными симптомами, при увеличенных размерах предстательной железы (> 40 мл) и повышенным уровне ПСА (> 1.4 – 1.6 нг/мл) [6]. Данные препараты могут использоваться в виде комбинации с другими группами. Влияние на уровень сывороточного ПСА должно учитываться при скрининговых исследованиях рака предстательной железы. Ингибиторы 5-α-редуктазы могут быть использованы как при длительной терапии ДГПЖ, так и при подготовке пациента к оперативному вмешательству.
α-адреноблокаторы
Препараты из группы блокаторов α1-адренорецепторов – важный элемент медикаментозной терапии доброкачественной гиперплазии предстательной железы. Накопленный опыт клинических и фундаментальных исследований красноречиво свидетельствует о роли нарушений симпатической регуляции в патогенезе этого заболевания.
α1-адренорецепторы локализуются в области шейки мочевого пузыря, простатическом отделе уретры, капсуле и строме предстательной железы. Их избыточная экспрессия и стимуляция закономерно приводит к гипертонусу гладкомышечных элементов нижних мочевыводящих путей и, следовательно, формированию функционального (динамического) компонента инфравезикальной обструкции. Расслабление мышечного аппарата в результате блокады α1-адренорецепторов приводит к уменьшению интенсивности обструктивных симптомов аденомы простаты.
Длительная инфравезикальная обструкция приводит к гипоксии мышечного слоя мочевого пузыря и постепенному развитию ремоделирования детрузора. Существует мнение, что вазодилатация пузырных артерий под воздействием α1-адреноблокаторов, уменьшая степень ишемии, способна замедлить или даже остановить этот патологический процесс. Помимо этого, их непосредственное угнетающее влияние на адренорецепторы мочевого пузыря приводит к смягчению ирритативных симптомов ДГПЖ. В этом отношении патогенетически обоснована комбинированная терапия с одновременным назначением M-холиноблокаторов (толтеродин, солифенацин и др.) [10].
Основной контингент пациентов с аденомой предстательной железы – пожилые мужчины, испытывающие проблемы с эректильной функцией. В связи с этим определённый интерес представляет тот факт, что блокада активности α1-адренорецепторов, благодаря их экспрессии в стенке пенильных артерий, имеет проэректильный эффект [11]. В ряде ситуаций при ДГПЖ с сопутствующей эректильной дисфункцией признана многообещающей терапевтическая схема с применением α1-адреноблокаторов и ингибиторов 5 изомера фосфодиэстеразы (ФДЭ-5). α1-адреноблокаторы и ингибиторы ФДЭ-5 в комбинации оказывают взаимный синергистический эффект в отношении как симптомов нижних мочевыводящих путей (lower urinary tract symptoms, LUTS), так и половой дисфункции [12, 13].
α1-адренорецепторы контролируют гладкомышечные элементы основных артерий человека, из-за чего применение α1-адреноблокаторов чревато развитием кардиоваскулярных осложнений, классическим примером которых является ортостатическая гипотензия. Эффективность α-адреноблокаторов и частота развития нежелательных эффектов при их приёме напрямую зависит от их селективности в отношении А-подтипа α1-адренергических рецепторов. Именно этот признак является основополагающим во внутренней классификации данной группы препаратов.
1. Селективные α1-адреноблокаторы: празозин, альфузозин, доксазозин, теразозин.
Препараты данной группы имеют одинаковую аффинность ко всем подтипам α1-адренергических рецепторов, из-за чего при их приёме относительно часты постуральная гипотензия и рефлекторная тахикардия. Теразозин и доксазозин положительно отличаются от аналогов в своей группе фармакокинетическими параметрами, а именно временем полувыведения – он составляет 12 ч и 19-22 ч соответственно. Это позволяет назначать препарат однократно на ночь, что преследует две цели: уменьшить выраженность ночной поллакиурии и одновременно снизить риск коллаптоидного состояния.
2. Сверхселективный α1A-адреноблокатор: тамсулозин.
Тамсулозин имеет 20-кратную селективность в отношении α1A-адренорецепторов. Благодаря этому, тамсулозин имеет существенно меньшую частоту развития сердечно-сосудистых осложнений, чем его предшественники. Его период полувыведения длится до 15 часов, однако при необходимости действие препарата может быть продлено при его применении в виде специальных лекарственных форм – капсул с замедленным высвобождением («Омник Окас», Astellas, Япония).
3. Ультраселективный α1A-адреноблокатор: силодозин.
С внедрением тамсулозина в клиническую практику поиски альтернативного α-адреноблокатора с наивысшей уроселективностью не остановились. Было разработано лекарственное вещество силодозин, присутствующее на российском рынке как препарат «Урорек» (Recordati, Италия). Эта особенность делает «Урорек» оптимальным в плане влияния на системную гемодинамику.
Подводя итог, следует подчеркнуть положительные и отрицательные моменты в использовании α-адреноблокаторов при доброкачественной гиперплазии предстательной железы. Эти препараты характеризуются быстрым наступлением эффекта с регрессом симптоматики, в основном – ирритативной, и тормозят процесс ремоделирования детрузора. Быстрое достижение эффекта позволяет применять адреноблокаторы при острой задержке мочеиспускания. Они синергистически взаимодействуют и хорошо работают в комбинации с М-холиноблокаторами и ингибиторами ФДЭ-5. Селективные α-адреноблокаторы не оказывают негативного влияния на либидо, эректильную функцию и способность к получению оргазма, а ряд исследований даже демонстрирует их проэректильные свойства. Гипотензивный эффект α-адреноблокаторов иногда может быть полезен у пациентов с сопутствующей артериальной гипертензией.
Эффект от применения α-адреноблокаторов является нестойким и сохраняется лишь при постоянном приёме. Они влияют только на динамический компонент инфравезикальной обструкции, не затрагивая органический, так как не приводят к уменьшению размеров простаты. Расслабление мускулатуры семенных пузырьков приводит к расстройствам эякуляции при сохранности оргазма. Имеются побочные эффекты в виде ортостатической гипотензии и назальной конгестии, хотя эта проблема частично решена у уроселективных препаратов.
Заключение. Каждая из рассмотренных групп препаратов для лечения ДГПЖ имеет свои достоинства и недостатки. Ингибиторы 5-α-редуктазы действуют медленно, но оказывают стойкий эффект, уменьшая органический компонент инфравезикальной обструкции. α-адреноблокаторы, напротив, оказывают быстрый эффект и воздействуют на динамический компонент обструкции. Таким образом, эти препараты отлично дополняют друг друга и, что немаловажно, являются фармакологически совместимыми. При хорошей комплаентности долгосрочная терапия комбинацией ингибиторов 5-α-редуктазы и α-адреноблокаторов позволяет избежать необходимости оперативного вмешательства, а значит ассоциированной с ним потери трудоспособности на определённый срок и риска развития осложнений.