Общее описание
Диабетическая нефропатия (ДН) — это поражение клубочкового аппарата почек вследствие диабетической микроангиопатии. Термином «ДН» часто обозначают специфическое поражение почек — диабетический гломерулосклероз (ДГ).
Распространенность диабетической нефропатии достигает 40–50% у больных с сахарным диабетом 1 типа и 15–30% у больных с сахарным диабетом 2 типа; возникает чаще у женщин. Диабетическая нефропатия является ведущей причиной высокой инвалидизации и смертности больных сахарным диабетом.
Причиной поражения сосудистой системы почек являются гипергликемия и повышенное артериальное давление. В этих условиях почки уже не могут в должной мере выполнять функцию фильтрации, поэтому в моче определяются вещества, которые в норме задерживаются почками и остаются в организме (например, белок).
Выделяют 3 стадии диабетической нефропатии:
- Стадия микроальбуминурии.
- Стадия протеинурии с сохранной азотовыделительной функцией почек.
- Стадия хронической почечной недостаточности.
Патогенетические механизмы формирования нефропатии при сахарном диабете 1 типа
В последние годы отмечается рост частоты вторичных болезней почек у детей, ассоциированных с нарушениями обмена веществ и другими эндокринными заболеваниями, которые имеют прогрессирующее течение с развитием хронической болезни почек (ХБП) и инвалидизацией пациентов уже в детском возрасте [1].
Сахарный диабет (СД) — одно из распространенных заболеваний детского возраста. В России зарегистрировано 2,3 млн больных диабетом, из них 14 тыс. детей и 10 тыс. подростков. Тяжелые специфические осложнения СД приводят к снижению трудоспособности, ухудшению прогноза жизни больного и определили СД 1 типа как важнейшую медико-социальную и экономическую проблему современного общества [2]. Одним из грозных осложнений СД 1 типа является поражение почек.
Тревожным является факт гиподиагностики диабетической нефропатии (ДН) в педиатрической практике [3].
Современные скрининговые тесты позволяют выявлять ДН только с 1-й клинической стадии — стадии микроальбуминурии (МАУ), пропуская при этом начальные структурные и функциональные нарушения, которые развиваются задолго до повышения экскреции альбумина [4].
Тубулоинтерстициальный фиброз — важный механизм утраты функциональной способности почек при СД, который предшествует гломерулосклерозу [5].
Повреждение тубулярного аппарата происходит на ранних этапах развития нефропатии, еще до появления явных клинических признаков, а нарушение функции эндотелия развивается задолго до возникновения структурных изменений в почках. Причем изменение параметров эндотелийзависимой вазодилатации происходит параллельно с уменьшением скорости клубочковой фильтрации и коррелирует с уровнями биомолекулярных маркеров воспаления [6].
Эндотелиальная дисфункция (ЭД) рассматривается как центральное звено патогенеза многих хронических болезней [7].
Дисфункция эндотелия является интегральным маркером поражения органов-мишеней при артериальной гипертензии (АГ), СД и метаболическом синдроме, и в первую очередь почек [8, 9].
В настоящее время под дисфункцией эндотелия понимают нарушение равновесия между образованием вазодилатирующих, атромбогенных, антипролиферативных факторов, с одной стороны, и вазоконстриктивных, протромботических и пролиферативных веществ, которые синтезирует эндотелий, — с другой [10].
Основные факторы, активирующие эндотелиальные клетки [11]:
- изменение скорости кровотока;
- тромбоцитарные факторы;
- гормоны и медиаторы (катехоламины, ацетилхолин, эндотелин, брадикинин, ангиотензин II (АТ II));
- гипоксия.
Маркерами ЭД считают снижение эндотелиального синтеза оксида азота (NO), повышение уровней эндотелина-1, циркулирующего фактора фон Виллебранда, ингибитора активатора плазминогена, гомоцистеина, тромбомодулина, растворимой молекулы сосудистой межклеточной адгезии B1, С-реактивного белка, микроальбуминурию и другие [12].
Эндотелиальная дисфункция предшествует развитию клинических проявлений заболеваний, в том числе и поражения почек, поэтому оценка функций эндотелия имеет большое диагностическое и прогностическое значение [7].
При СД 1 типа гипергликемия индуцирует неферментное гликирование белков, окислительный стресс, активирует протеинкиназу С, митоген-активирующую протеинкиназу, действие факторов роста, вазоактивных факторов, цитокинов, вызывающих повреждение почек на уровне клетки. Это ведет к развитию почечной гипертрофии и аккумуляции экстрацеллюлярного матрикса, предшествующих таким необратимым изменениям, как гломерулосклероз и тубулоинтерстициальный фиброз [6]. Одним из основных механизмов развития и прогрессирования ДН считают внутриклубочковую гиперфильтрацию и гипертензию, которая является ведущим гемодинамическим фактором прогрессирования ДН [13]. Этот механизм активизируется хронической гипергликемией, вызывая вначале функциональные, а затем структурные изменения в почках, протекающие латентно и приводящие к появлению МАУ. Основными пусковыми механизмами появления МАУ помимо гипергликемии являются эндотелиальная дисфункция и клубочковая гиперфильтрация. Повышение внутриклубочкового давления происходит по причине сужения выносящей артериолы в результате непосредственного влияния на эндотелий сосудов или гиперактивации симпатической нервной системы. В результате данных изменений наблюдается усиление процессов фильтрации — гиперфильтрация — и увеличение поступления альбуминов в первичную мочу [14]. Микроальбуминурия является доказанным высокочувствительным маркером прогностически неблагоприятного поражения почек, а также отражает наличие ЭД. Появление МАУ свидетельствует о наличии склероза не менее 20–25% нефронов, а прогрессирование до стадии протеинурии — о потере 50–70% клубочков, что указывает на необратимое поражение почек, что резко снижает эффективность проводимой терапии, а прогрессивное снижение фильтрационной функции почек становится неизбежным [15].
Длительное воздействие гипергликемии и мощного гемодинамического удара («shear stress») инициирует механическое раздражение прилежащих структур клубочка, что способствует гиперпродукции коллагена и накоплению его в области мезангиума, начальным склеротическим процессам, нарушению архитектоники и проницаемости базальной мембраны клубочка [16].
Гемодинамический удар способен сам приводить к повышению экспрессии эндотелиальными клетками некоторых вазоактивных молекул с преимущественно вазоконстрикторным действием — ангиотензина II, эндотелина-1, молекул адгезии (VCAM-1), компонентов эндотелий-зависимого звена гемостаза — PAI-1 (ингибитора активатора плазминогена типа 1) [17]. Наряду с этим в почках снижается активность коллагенолитических ферментов. В итоге происходит избыточная аккумуляция коллагена, которая становится ключевым звеном в развитии диабетического нефросклероза.
Внутриклубочковая гиперфильтрация запускает компенсаторный каскад активации системы «ренин — ангиотензин — альдостерон» (РААС), которая вносит свой дальнейший вклад в прогрессирование функциональных и гемодинамических нарушений в почках [18].
Механизмы патогенного действия ангиотензина II (АII) при СД обусловлены не только его мощным вазоконстрикторным действием, но и пролиферативной, прооксидантной и протромбогенной активностью. В почках АII вызывает внутриклубочковую гипертензию, способствует склерозированию и фиброзированию почечной ткани опосредованно через выброс цитокинов и факторов роста [6].
АТII, в том числе его локально-почечный пул, стимулирует пролиферацию мезангиальных клеток и продукцию ими коллагенов, факторов хемотаксиса и трансформирующего фактора роста β1, которые способствуют нарастанию макрофагальной инфильтрации, тубулоинтерстициального воспаления и фиброза и в итоге — прогрессированию гломерулосклероза. Кроме того, АТII непосредственно увеличивает проницаемость базальной мембраны клубочков, таким образом способствуя нарастанию протеинурии. Вызывая спазм преимущественно выносящей артериолы, АТII обусловливает повышение внутриклубочкового давления и увеличение градиента почечного транскапиллярного давления. Спазм клубочковых артерий может приводить к перераспределению крови в почке: увеличивается шунтирование ее в сосуды почечных пирамид, что ведет к частичной ишемии структур почечной коры [19].
АГ играет ключевую роль в развитии и прогрессировании ДН, также как и в развитии макроваскулярной патологии. По мере прогрессирования ДН роль метаболических факторов снижается и возрастает роль гемодинамических (АГ, внутриклубочковая гипертензия) [6].
В исследованиях последних лет установлено прямое повреждающее действие на структуру почечной ткани и эндотелий сосудов почек гиперхолестеринемии, атерогенных фракций липидов, липидных медиаторов (простагландинов), цитокинов, таких как фактор некроза опухоли альфа (ФНО-α), интерлейкины-1, 6, 8 [19, 20].
ФНО-α, являясь одним из ключевых провоспалительных факторов, стимулирует активацию ядерного фактора транскрипции c последующим увеличением синтеза эндотелина-1 в мезангиальных клетках почек и активацией процессов пролиферации и склероза в почечной ткани [21].
Также известно, что мезангиальные клетки почечных клубочков имеют рецепторы к липопротеидам низкой плотности, что в условиях гиперлипидемии способствует их накоплению, в том числе и окисленных форм. Окисленные формы вызывают повреждение белков клеточной стенки. В результате активации протеолитических систем мезангий инфильтрируется макрофагами и мононуклеарами, выделяющиеся при этом факторы роста и цитокины вызывают увеличение продукции компонентов мезангиального матрикса и вещества базальной мембраны клубочков (БМК). Липопротеиды, отложившиеся в почечной ткани, связывают отрицательно заряженные гликозаминогликаны БМК, нейтрализуя заряд и повышая ее проницаемость. Происходит снижение активности NO-синтазы, уменьшение синтеза простациклина, что приводит к повышению выработки эндотелием сосудов вазоконстрикторных веществ (эндотелин-1, тромбоксан А2), нарушается сосудодвигательная функция эндотелия [22, 23].
Установлена роль влияния липидов в биологии подоцитов. После воздействия различных патогенных факторов (метаболических, токсических, гемодинамических) подоциты подвергаются структурно-функциональным изменениям, что называется подоцитопатиями. Признаками подоцитопатии являются сглаживание ножек подоцитов с нарушением проницаемости щелевидной диафрагмы, гипертрофия, апоптоз, отслоение подоцитов от БМК со слущиванием их в мочевое пространство и появлением в моче как целых клеток (подоцитурия), так и его структурных белков (нефрина, подоцина и др.), уменьшение количества подоцитов в клубочке (подоцитопения). В настоящее время установлено, что феномен сглаживания ножковых отростков представляет собой неспецифическую реакцию эпителиальной клетки на действие патогенного фактора. Нефрин-трансмембранный белок, участвующий в связывании с актиновым цитоскелетом подоцитов, с другой стороны, через взаимодействие экстрацеллюлярных доменов между собой — в формировании межподоцитарной щелевой диафрагмы. При целостности пор через барьер не могут пройти крупные белковые молекулы, например, сывороточный альбумин [24–26]. Усиливающаяся в результате этих повреждений фильтрация белка в свою очередь может приводить к избыточной секреции эпителием проксимальных канальцев специфического почечного фактора фиброза MCP-1, экспрессия которого индуцируется гипергликемией. МСР-1 вызывает усугубление процессов воспаления и фиброза в почечных канальцах и интерстиции. Усиленная экскреция нефрина с мочой позволяет судить о подоцитопатии [24, 25].
В патогенезе ЭД при СД играют роль факторы прогресирования ДН (гипергликемия, дислипидемия, внутриклубочковая гипертензия и цитокины), которые вызывают глубокое повреждение сосудистого эндотелия и приводят к выбросу «медиаторов» повреждения (ангиотензины, эндотелины, цитокины, С-реактивный белок, ФНО и др.), способствуя инициации и прогрессированию диабетических микроангиопатий [27].
Тем не менее развитие ДН далеко не всегда зависит от уровня компенсации углеводного обмена и длительности СД, что позволило предположить существование генетических факторов, обуславливающих ту или иную степень чувствительности сосудов почек к воздействию метаболических и гемодинамических нарушений [28].
В настоящее время основным подходом в изучении генетической предрасположенности к диабетическим ангиопатиям является использование полиморфных маркеров, сцепленных с различными генами-кандидатами (гены, продукты экспрессии которых могут прямо или косвенно участвовать в развитии патологии) [29, 30].
Известно, что в патогенезе ДН важнейшую роль играет баланс между активностью прессорной ренин-ангиотензиновой системы [31, 32] и депрессорной системы синтеза NO [33].
Таким образом, интерес представляют генетические детерминанты РААС. Среди последних немало внимания уделено гену ангиотензин I превращающего фермента, в том числе его инсерционно-делеционному полиморфному маркеру. Под действием этого фермента происходят образование ангиотензина II — наиболее активного сосудосуживающего пептида и деградация брадикинина — важного сосудорасширяющего фактора [34].
К наследственным факторам, прямым или косвенным образом формирующим генетическую предрасположенность к данной патологии, относится ген эндотелиальной NO-синтазы (eNOS). Некоторые авторы рассматривают потенциальную роль этого гена как фактор риска развития атеросклероза и заболеваний, приводящих к нарушению нормальной выработки окиси азота [35].
Тем не менее ведущую роль в прогрессировании ДН до терминальных стадий играют гемодинамические факторы (артериальная гипертензия), в то время как роль метаболических и генетических факторов в прогрессировании ДН ослабевает [28].
Своевременная диагностика ДН на ранних стадиях у больных СД представляет собой очень важную задачу. Необходим поиск доступных маркеров ранней стадии поражения почек и создание алгоритма формирования групп риска диабетической нефропатии [36].
Для пациентов, заболевших диабетом в детском возрасте, эта проблема наиболее актуальна, так как у детей СД 1 типа протекает лабильно, с частыми декомпенсациями, что может способствовать более раннему развитию осложнений, в том числе и ДН [37].
Установлено, что патология почек при СД 1 типа у детей формируется на фоне нарушений углеводного и липидного обмена, изменений внутрипочечной гемодинамики, гиперлептинемии и инфицированности мочевой системы патогенной урофлорой [38].
В развитии тубулоинтерстициального повреждения почек определена роль сложных процессов межклеточных взаимодействий, которые активизируются под влиянием иммунных и неиммунных факторов [6].
Таким образом, необходимо комплексное клинико-лабораторное обследование больных сахарным диабетом 1 типа с применением молекулярно-биологических технологий с целью профилактики развития ДН наряду с оценкой метаболических показателей (гипергликемия, дислипидемия) и гемодинамических (артериальная гипертензия), маркеров ЭД, а также генетических факторов риска ДН [28].
Литература
- Вялкова A. A. Хроническая болезнь почек в педиатрической нефрологии / Материалы Международной школы и научно-практической конференции по детской нефрологии «Актуальные проблемы детской нефрологии». Оренбург, 2010. С. 63–75.
- Шестакова М. В., Чугунова Л. А., Шахмалова М. Ш., Дедов И. И. Диабетическая нефропатия: достижения в диагностике, профилактике и лечении // Сахарный диабет. 2005. № 3. С. 22–25.
- Шестакова М. В. Диабетическая нефропатия: фатальное или предотвратимое осложнение? // Рус. мед. журнал. 2007. № 3.
- Дедов И. И., Шестакова М. В. Сахарный диабет и хроническая болезнь почек. М.: ООО «Медицинское информационное агентство», 2009. С. 482.
- Шамхалова М. Ш., Курумова К. О., Клефортова И. И., Ситкин И. И., Ильин А. В., Арбузова М. И., Гончаров Н. П., Кация Г. В., Александров А. А., Кухаренко С. С., Шестакова М. В., Дедов И. И. Факторы развития тубулоинтерстициального повреждения почек у больных сахарным диабетом // Сахарный диабет. 2010. № 3. С. 134–141.
- Шестакова М. В., Шамхалова М. Ш., Ярек-Мартынова И. Я., Клефортова И. И., Сухарева О. Ю., Викулова О. К., Зайцева Н. В., Мартынов С. А., Кварацхелия М. В., Тарасов Е. В., Трубицына Н. П. Сахарный диабет и хроническая болезнь почек: достижения, нерешенные проблемы и перспективы лечения // Сахарный диабет. 2011. № 1. С. 81–88.
- Мельникова Ю. С., Макарова Т. П. Эндотелиальная дисфункция как центральное звено патогенеза хронических болезней // Казанский медицинский журнал. 2015. Т. 96, № 4. С. 659–665.
- Кочуева М. Н., Гаврилюк В. А. Нейроэндокринные механизмы развития нефропатии у больных эссенциальной артериальной гипертензией с ожирением // Схiдноєвропейський журнал внутрiшньої та сiмейної медицини. 2014. № 1. С. 43–50.
- Sharma K. Adiponectin regulates albuminuria and podocyte function in mice // J. Clin. Invest. 2008. Vol. 118. Р. 1645–1656.
- Группа . Маркеры дисфункции эндотелия. В кн.: Каталог Группы . М., 2005. С. 49–50.
- Dzau V., Bernstein K., Celermaier D. et al. The relevance of tissue angiotensin-converting enzyme: manifestations in mechanistic and endpoint data // Am J Cardiol. 200. Vol. 88 (suppl. L). Р. 1–20.
- Конюх Е. А., Парамонова Н. С. Клинические особенности течения острого и хронического гломерулонефритов у детей с дисфункцией эндотелия // Журнал ГрГМУ. 2010, № 2. С. 149–151.
- Арутюнов Г. П., Оганезова Л. Г. Часто задаваемые вопросы о скорости клубочковой фильтрации // Клиническая нефрология. 2009. № 3. С. 35–42.
- McCullough P. A., Li S., Jurkovitz C. T. et al. Chronic kidney disease, prevalence of premature cardiovascular disease, and relationship to shortterm mortality // Am Heart J. 2008. Vol. 156. Р. 277–283.
- Шестакова М. В. Современное понятие «хроническая болезнь почек»: методы диагностики, клиническое значение // Сахарный диабет. 2008. № 2. С. 4–7.
- Brenner B. M., Hostetter T., Humes H. D. Molecular basis of proteinuria of glomerular origin // N. Engl. J. Med. 1978. № 298. P. 826–833
- Беляева О. Д., Баженова Е. А., Березина А. В. и др. Уровень лептина, распределение генотипов и встречаемость аллелей А19 G полиморфизма гена лептина у пациентов с абдоминальным ожирением // Арт. гипертенз. 2009, № 4. С. 440–444.
- Garrido A. M., Griendling K. K. NADPH oxidases and angiotensin II receptor signaling // Molecular and Cellular Endocrinology. 2009. Vol. 302, № 2. Р. 148–158.
- Wiecek A., Kokot F., Chudek J., Adamczak M. The adipose tissue — a novel endocrine organ of interest to the nephrologists // Nephrol Dial Transplant. 2002. № 17. Р. 191–195.
- Николаева С. Н., Лебедева Е. Н., Вялкова А. А. и др. Клиническая оценка уровня лептина и инсулина в крови у детей с ожирением // Совр. вопр. педиатрии. 2007. С. 485–486.
- Sharma K., McCue P., Dunn S. Diabetic kidney disease in the db/db mouse // Am J Renal Physiol. 2003. Vol. 284. Р. 1138–1144.
- Крячкова А. А., Савельева С. А., Галлямов М. Г. и др. Роль ожирения в поражении почек при метаболическом синдроме // Нефрология и диализ. 2010. Т. 12, № 1. С. 34–38.
- Нанчикеева М. Л., Козловская Л. В., Фомин В. В. и др. Эндотелиальная дисфункция и ремоделирование внутрипочечных сосудов как основа формирования гипертонической нефропатии // Ультразвуковая и функциональная диагностика. 2009. № 5. С. 84–94.
- Foster R. R., Saleem M. A., Mathieson P. W., Bates D. O., Harper S. J. Vascular endothelial growth factor and nephrin interact and reduce apoptosis in human podocytes // Am J Physiol Renal Physiol. 2005. Vol. 288, № 1. Р. 48–57.
- Fornoni A., Merscher S., Kopp J. B. Lipid biology of the podocyte — new perspectives offer new opportunities // Nat Rev Nephrol. 2014, Vol. 10, № 7. Р. 379–88.
- Бобкова И. Н., Шестакова М. В., Щукина А. А. Повреждение подоцитов при сахарном диабете // Сахарный диабет. 2014. № 3. С. 39.
- Дедов И. И., Шестакова М. В. Диабетическая нефропатия. М.: Универсум Паблишинг, 2000. 239 с.
- Викулова О. К. Клинико-лабораторные и генетические факторы развития и прогрессирования диабетической нефропатии у больных сахарным диабетом 1 типа. Автореф. дис. … к.м.н. М., 2003. С. 123.
- Кондратьев Я. Ю., Шестакова М. В., Чугунова Л. А. и соавт. Стратегия поиска маркеров генетической предрасположенности к сосудистым осложнениям сахарного диабета на примере диабетической нефропатии // Сахарный диабет. 1998. № 1. С. 22–25.
- Abbut Z. A., Wilson A. C., Cosgrove N. M. et al. Angiotensin-converting enzyme gene polymorphism in systemic hypertension // Am J Cardiol. 1998. Vol. 81. Р. 244–246.
- Apperloo A. J., de Zeeuw D., de Jong P. E. Short-term antiproteinuric respons to antihypertensive treatment predicts long-term GFR decline in patients with non-diabetic renal disease // Kidney Int. 1994. Vol. 45, Suppl. 45, p. S174-S178.
- Jones S. C., Thomas Т. Н., Marshall S. M. Abnormal regulation of cell membrane fluidity in diabetic nephropathy // Diabetologia. 1998. Vol. 41, Iss. 3, р. 337–342.
- Шестакова М. В., Чугунова JI. A., Шамхалова М. Ш., Носиков В. В. Генетические факторы в развитии диабетической нефропатии. М., 2002.
- Kuixing Yi. Z. et al. Angiotensin II type 2 recepter gene polymorphisms and essential hypertension // Acta Pharmacol Sin. 2003. Vol. 24, № 11. P. 1089–1090.
- Бондарь И. А., Климонтов В. В., Поршенников И. А. Оксид азота и диабетические ангиопатии // Сахарный диабет. 1999. № 4. С. 11–14.
- Мухин Н. А., Арутюнов Г. П., Фомин В. В. Альбуминурия — маркер поражения почек и риска сердечно-сосудистых осложнений // Нефрология. 2009. № 1. С. 12–17.
- Дедов И. И., Петеркова В. А., Кураева Т. Л. и др. Осложнения сахарного диабета у детей и подростков. М.: ГУ ЭНЦ РАМН, 2003. 96 с.
- Вялкова А. А., Савельева Е. В., Кулагина Е. П., Белова М. А. Ранняя диагностика поражения почек у детей с сахарным диабетом 1 типа // Педиатр (материалы конференции). 2021. Т. 7, вып. 2, с. 187–188.
Л. В. Куценко И. В. Зорин1, доктор медицинских наук, профессор А. А. Вялкова, доктор медицинских наук, профессор
ФГБОУ ВО ОрГМУ МЗ РФ, Оренбург
1 Контактная информация
Патогенетические механизмы формирования нефропатии при сахарном диабете 1 типа Л. В. Куценко, И. В. Зорин, А. А. Вялкова Для цитирования: Лечащий врач № 6/2018; Номера страниц в выпуске: 58-61 Теги: сахарный диабет, осложнения, поражение почек, маркеры ранней стадии
Клиническая картина
- Протеинурия (1 стадия — небольшое количество белка в моче, 2 и 3 стадия — большое количество белка в моче).
- Артериальная гипертензия (1, 2 и 3 стадия).
- Никтурия (учащенное ночное мочеиспускание) (3 стадия).
- Полиурия (выделение 2–4 литров мочи в сутки) (3 стадия).
- Одышка, боли в области сердца (3 стадия).
- Сухость и горечь во рту, отсутствие аппетита, боли и тяжесть в подложечной области, жидкий стул.
- Носовые и желудочно-кишечные кровотечения, кожные кровоизлияния (3 стадия).
- Общая слабость, появляются тошнота, рвота, кожный зуд, мышечные подергивания (3 стадия).
Лечение диабетической нефропатии
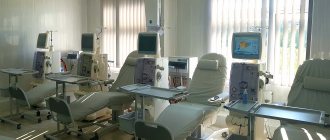
Лечение начинается с нормализации уровня сахара крови. При артериальной гипертензии — нормализация артериального давления ингибиторами АПФ, которые при постоянном приеме замедляют прогрессирование нефропатии. Нефропротективный эффект усиливается при добавлении «Верапамила». Показана нормализация уровня холестерина. Требуется ограничение в рационе животного белка. На 3-й стадии необходима коррекция водно-электролитного обмена и методы заместительной почечной терапии: гемодиализ, перитонеальный диализ, трансплантация почки.
Основные лекарственные препараты
Имеются противопоказания. Необходима консультация специалиста.
- Эналаприл (ингибитор АПФ, гипотензивное средство, нефропротектор). Режим дозирования: принимать внутрь 2,5-10 мг 2 раза в сутки, постоянно.
- Верапамил (антиаритмическое, антиангинальное и антигипертензивное средство, нефропротектор). Режим дозирования: препарат принимают внутрь, до еды, запивая небольшим количеством воды. Для профилактики приступов стенокардии, аритмии и при лечении артериальной гипертензии препарат назначают взрослым в начальной дозе по 40-80 мг 3-4 раза в день. При необходимости увеличивают разовую дозу до 120-160 мг. Максимальная суточная доза препарата составляет 480 мг. Продолжительность лечения устанавливаются индивидуально в зависимости от состояния больного, степени тяжести, особенностей течения заболевания и эффективности терапии.
- Валсартан (антигипертензивное средство, нефропротектор). Режим дозирования: принимать внутрь по 80-160 мг 1 раз в сутки, постоянно.
- Аторвастатин (гиполипидемический препарат). Режим дозирования: принимать внутрь по 5-20 мг 1 раз в сутки, длительность терапии определяют индивидуально.
Профилактика
Для пациентов-диабетиков профилактика нефропатии должна включать несколько основных пунктов:
- поддержка в крови безопасного уровня сахара (регулировать физические нагрузки, избегать стрессов и постоянно измерять уровень глюкозы);
- правильное питание (диета с пониженным процентом белков и углеводов, отказ от сигарет и спиртного);
- контроль за соотношением липидов в крови;
- слежение за уровнем АД (если подскакивает выше 140/90 мм рт.ст., срочно надо принимать меры).
Все меры профилактики необходимо согласовывать с лечащим врачом. Лечебную диету тоже надо проводить под строгим контролем эндокринолога и нефролога.
Заболеваемость (на 100 000 человек)
| Мужчины | Женщины | |||||||||||||
| Возраст, лет | 0-1 | 1-3 | 3-14 | 14-25 | 25-40 | 40-60 | 60 + | 0-1 | 1-3 | 3-14 | 14-25 | 25-40 | 40-60 | 60 + |
| Кол-во заболевших | 0.01 | 0.05 | 0.1 | 5 | 5 | 10 | 15 | 0.01 | 0.05 | 0.1 | 5 | 5 | 10 | 15 |